
Cultivo de salmónidos
1. Introducción
El cultivo de salmónidos se ha transformado en un símbolo de prosperidad comercial para la economía nacional. Pese a que el salmón no es una especie natural de las costas chilenas, las extraordinarias condiciones climáticas y ambientales de la zona austral, han permitido una exitosa inserción de esta especie (Furci y cols., 2006).
La acuicultura fue denominada como la “revolución azul” y catalogada como la gran solución para disminuir la presión sobre los recursos pesqueros intensamente explotados, debido a la mayor demanda de proteínas de origen marino.

Algunos investigadores han señalado que la acuicultura no sólo puede contribuir significativamente a las demandas de alimentación mundial, sino que puede además ayudar directamente a la conservación de los recursos acuáticos y su diversidad genética (Neira y Díaz, 2005).
El objetivo de la acuicultura de salmónidos en este momento se enfoca obtener productos de calidad a un precio competitivo, para lo cual se deben elaborar alimentos apropiados y altamente estandarizados a partir de ingredientes estables y de buena calidad (Ackman, 1998).
1.1. Dieta del salmón
El factor de mayor impacto en la composición química del músculo de salmón es la composición de su alimento. El acuicultor está interesado en hacer crecer el pez lo más rápido posible empleando la menor cantidad de alimento, dado que el alimento constituye el mayor componente del costo en acuicultura. El potencial de crecimiento es mayor cuando el pez es alimentado con una dieta rica en lípidos, para propósitos energéticos, y alto contenido de proteínas con una composición balanceada de aminoácidos (FAO, 1999).

El alimento estándar en el comienzo del cultivo de salmón en Canadá, contenía harina de pescado secada al vapor, usualmente elaborada a partir de arenque (Lall, 1987). Hoy la alimentación del salmón en cultivo es un proceso altamente tecnificado y científicamente elaborado, siendo los componentes más importantes de la dieta artificial la harina y aceite de pescado (Valenzuela, 2005).
Las harinas de pescado producidas alrededor de todo el mundo contienen los mismos tipos de lípidos, mayoritariamente poliinsaturados. Si en ésta no se usa un antioxidante (ejemplo: etoxiquina) se oxidarán algunos de los ácidos grasos.
Si la harina de pescado es estabilizada con antioxidante hay pocos cambios posteriores en los ácidos grasos. Si no es estabilizada, entonces los ácidos grasos saturados y los ácidos grasos monoinsaturados permanecen igual, pero generalmente hay una pérdida considerable, a través de la oxidación, de los ácidos grasos de cadena larga altamente insaturados omega - 3, considerados como esenciales para la nutrición de los salmónidos (Ackman, 1998). El aceite de pescado, por su parte, además de constituir un aporte energético importante, le permite incorporar los ácidos grasos poliinsaturados de cadena larga omega – 3 fundamentales para su crecimiento y desarrollo (Valenzuela, 2005). Se debe estabilizar el aceite con antioxidantes sintéticos utilizando DHA y BHT (FAO, 1999).
Otro factor a considerar es el color rojo anaranjado intenso del salmón, el cual se obtiene al agregar carotenoides artificiales como astaxantina y cantaxantina, los cuales además de ser pigmentantes, que otorgan al músculo de salmón un color rosado atractivo para el consumidor, son antioxidantes que mejoran la calidad y estabilidad del músculo una vez procesado (Valenzuela, 2005).
1.1.1. Antioxidantes en dieta para salmón
La inclusión de antioxidantes en la dieta animal es un método efectivo para incrementar la estabilidad oxidativa del músculo, especialmente en aquellos productos en los que la adición del antioxidante en el producto final puede resultar dificultosa (Carreras, 2004).
Los antioxidantes son moléculas orgánicas de origen sintético o natural, capaces de evitar o retardar el desarrollo del deterioro oxidativo.

Se les considera aditivos alimentarios por ser aportados a los alimentos intencionalmente, sin el propósito de cambiar su valor nutritivo, sino con la finalidad de favorecer su conservación y mejorar su adaptación al uso al que se destinan (Fernández San Juan, 2002).
Se ha despertado un especial interés en el uso de fuentes alternativas de compuestos naturales con propiedades antioxidantes, debido a estudios sugiriendo efectos mutagénicos y carcinogénicos de algunos antioxidantes sintéticos, junto con el aumento de la preocupación de los consumidores por la seguridad alimentaria (Carreras, 2004).
Mercados como el japonés, principal destino a nivel nacional en los embarques de salmón y la distribución de los productos exportados con un un 48% de salmón coho congelado, 45% de trucha (91% congelado) y 7% de salmón atlántico (96% congelado) (Revista Aqua, 2007), exige límites máximos para antioxidantes sintéticos como el BHT (Servicio Nacional de Pesca, 2007). Esto indica la necesidad del uso de antioxidantes naturales en el salmón.
1.1.1.1.1. Butilhidroxitolueno (BHT)
El BHT (Figura 1) tiene apariencia de un polvo blanco cristalino y posee excelente solubilidad en varios aceites y grasas, por lo cual es utilizado en aceite de pescado. Pero no es muy eficiente, si se compara a otros antioxidantes, para que su efecto se refuerce, generalmente debe utilizarse en conjunto con otro antioxidante (Vieira, 2000).
La acción antioxidante del BHT es similar a la de la vitamina E, dona eficientemente un átomo de hidrógeno a un radical peroxi o alcohoxi, interfiriendo con la propagación de la peroxidación lipídica (López, 1996).
.jpeg)
1.1.1.1. Antioxidantes sintéticos
Los antioxidantes sintéticos fueron desarrollados a partir de la necesidad de obtener una protección más efectiva y, al mismo tiempo, más económica en relación a los antioxidantes naturales (Vieira, 2000). En general, los antioxidantes sintéticos se caracterizan por su elevada actividad química, alta eficacia a dosis bajas, costo reducido y alta estabilidad (Costa - Batllori, 2003).

_Structural_Formula_V1_svg.png)
Figura 1: Estructura química del BHT o butilhidroxitolueno (E-321)
1.1.1.1.2. Etoxiquina
La etoxiquina es un antioxidante utilizado en la industria alimentaria, en especial en la fabricación de harina de pescado (Castañeada y cols., 1999), estabiliza las grasas y protege el valor nutricional del alimento, incluidas las vitaminas liposolubles A, D, E y K (Revista Aqua, 2006).

Etoxiquina
1.1.1.2. Antioxidantes naturales
Los extractos naturales se han utilizado mayoritariamente con fines terapéuticos.
Estos extractos están constituidos por compuestos de diferente naturaleza química; polifenoles, isoprenoides, compuestos tiólicos, ácido ascórbico y polisacáridos que en conjunto contribuyen, bajo diferentes mecanismos, a ejercer la capacidad antioxidante característica de un preparado natural. La presencia y proporción de ellos en los preparados naturales, dependerá principalmente de la planta utilizada como materia prima y del solvente utilizado en la extracción. Estos compuestos, además de su rol preservante del alimento, pueden actuar como antioxidantes biológicos en el consumidor, a través de diferentes mecanismos (Gormaz, 2005).
1.1.1.2.1. Romero (Rosmarinus officinalis)
El extracto de romero contiene cuatro compuestos con acción antioxidante: carnosol, osmanol, isorosmanol y rosmaridifenol (Carreras, 2004), entre los que destaca el carnosol, que sería responsable de la actividad antioxidante del romero en materias grasas (Bruneton, 2001).

1.1.1.2.2. Tocoferoles
Entre los antioxidantes naturales, los más utilizados son los tocoferoles, popularmente conocidos como vitamina E. Este término hace referencia a una familia de compuestos relacionados estructuralmente y que incluye todos los derivados del tocol y tocotrienol que manifiestan la actividad biológica del α-tocoferol (Carreras, 2004).

Tocoferol
Los tocoferoles generalmente se extraen del destilado del aceite de soya, un subproducto del proceso de fabricación del aceite de soya comestible. Poseen buena eficiencia en grasas animales y son una alternativa en países cuya legislación no permite el uso de los antioxidantes sintéticos (Vieira, 2000).
1.2. Salmón coho o del Pacífico (Oncorhynchus kisutch)
Esta especie es originaria de las costas del Océano Pacífico y fue introducida en Chile a principios del siglo XX (Figura 2). La introducción exitosa del Salmón coho, en el sur de Chile fue posible a partir de 1976 (Campos, 1981). La producción mundial se ha más que duplicado entre 1986 y 1996 y Chile se encuentra entre los principales productores de salmón en el mundo (Naylor y cols., 1998). Los principales mercados de destino de esta especie son Japón y Estados Unidos (Salgado, 2005).

Tiene en promedio 45 centímetros de longitud, llegando en el momento de su cosecha a un peso de 3 kilos. Su color es pardo, verde o azul en el dorso, los costados son plateados y el vientre plateado blanquecino (Salgado, 2005).
La temporada de cosecha del Salmón coho es muy corta, habitualmente va de dos a tres meses, abarcando los meses de Noviembre y Diciembre.

Figura 2: Salmón coho o del pacifico (Oncorhynchus kisutch)
Esta especie se distingue del Atlántico en que son semélparos, es decir, mueren después de reproducirse (Salgado, 2005).
El contenido de proteína del Salmón coho criado en piscina es de 21.27 %, valor muy similar al del Salmón coho que vive en un ambiente natural el cual es de 21.62 %
Su contenido total de lípidos es de 7,67 %, presentando una cantidad de ácidos grasos poliinsaturados (PUFA) de 1,86 % y un 3,33 % de ácidos grasos monoinsaturados (MUFA) (Agricultural Research Service, 2007).
1.3. Fracción proteica del salmón
Las proteínas del músculo del pez se pueden dividir en tres grupos:
Proteínas estructurales: (miosina, actina, tropomiosina, troponina). Constituyen el 70 - 80 % del contenido total de proteínas (comparado con el 40 % en mamíferos) (FAO, 1999).

Las proteínas miofibrilares son las proteínas estructurales que conforman las miofibrillas, las que contienen la unidad estructural básica responsable de la contracción muscular en los animales (Pearson y Young, 1989).
Proteínas sarcoplasmáticas: (mioalbúmina, globulina y enzimas metabólicas), esta fracción constituye el 25-30 % del total de proteínas (FAO, 1999).
Se encuentran cerca de 100 diferentes proteínas sarcoplasmáticas, la mayoría enzimas involucradas en el metabolismo. (Pearson y Young, 1989) El grupo de proteínas sarcoplasmáticas es característico de cada especie marina. Esta fracción de proteínas solubles en agua es la que se utiliza mayoritariamente para la identificación de especies por métodos electroforéticos (Rehbein, 1995).
Proteínas del tejido conectivo: (colágeno), que constituyen aproximadamente el 3 % del total de las proteínas en teleósteos, cerca del 10 % en elasmobranquios y escaso en el caso del salmón, comparado con el 17 % en mamíferos (FAO, 1999).
El tejido conectivo provee de fuerza y soporte para el sistema muscular. Las propiedades de estos tejidos se deben principalmente a dos proteínas extracelulares, colágeno y elastina (Pearson y Young, 1989).
La modificación de parte de la fracción enzimática se puede evaluar midiendo su actividad proteolítica (AP), actividad de glutación peróxidasa (GSH – Px) y presencia de metaloproteinasas (MMP’s).
1.3.1. Actividad proteolítica
El músculo de pescado posee muchas y diferentes proteasas (Stoknes y Rustad, 1995) y el efecto de la descomposición proteolítica está generalmente relacionado con un extenso ablandamiento del tejido (FAO, 1999). Las proteínas endógenas, las cuales tienen la capacidad de hidrolizar diferentes proteínas en el músculo, son de importancia en los procesos de deterioro (Cepeda y cols., 1990). Por otro lado la actividad proteolítica (AP) también se ve asociada al nivel microbiológico, sin embargo y dado que sólo un número limitado de microorganismos realmente invade el músculo y el crecimiento microbiano se lleva a cabo principalmente en la superficie, el deterioro es probablemente una consecuencia de la difusión de enzimas bacterianas hacia el interior del músculo y de la difusión externa de nutrientes (FAO, 1999).
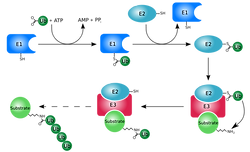
Si bien han sido aisladas varias enzimas proteolíticas en el tejido del pescado, han sido las catepsinas las que quizás se han descrito con mayor frecuencia. Las catepsinas son proteasas "ácidas" que usualmente se encuentran empacadas en diminutos organelos submicroscópicos llamados lisosomas (FAO, 1999). La alta AP ocurre en músculo y carne picada, debido a la ruptura de los lisosomas que las contienen (Chang-Lee y cols., 1989).
En el tejido vivo, se cree que las proteasas lisosomales son responsables de la degradación proteica en las áreas de daño. De esta forma, las catepsinas están generalmente inactivas dentro del tejido vivo pero son liberadas dentro de los fluidos celulares luego de abuso físico o congelación y descongelación post mortem del músculo (FAO, 1999). Hultamnn y Rustad (2004) indican que cuando los tejidos miofibrilares y conectivos son desnaturados, las proteínas son extremadamente susceptibles a la acción hidrolítica de la catepsina B.
Un factor postmorten que influye en la textura del pescado, importante característica de calidad, es la razón y extensión de la proteolisis causante del quiebre del tejido miofibrilar y conectivo (Hultmann y Rustad, 2004). Además, muchas proteínas del músculo participan en la degradación durante el almacenamiento y procesamiento, y son de gran importancia en el congelamiento y preservación del pescado (Pérez-Borla, 2002). La AP del músculo ha sido descrita como cambios en las proteínas miofibrilares las cuales afectan la calidad del músculo de pescado (Kinoshita y cols., 1990).
1.3.2. Glutatión peróxidasa
La glutación peróxidasa (GSH - Px), es una enzima de selenio dependiente que cataliza la reducción del peróxido de hidrógeno (H₂O₂) o lipoperóxido (L-OOH), utilizando como agente reductor la glutación reducida (GSH) (Cisneros y cols., 1997).
Esta enzima fue reportada por primera vez por Mills y Randall (1957) en eritrocitos bovinos y más tarde en diferentes tejidos, como pulmón de ratas (Chiu y cols., 1976) e hígado (Little y cols., 1968).
La GSH - Px, como parte del mecanismo de defensa antioxidante, evita la oxidación de los L-OOH, reduciéndolos en presencia de GSH. Desempeña así un importante papel en la defensa antioxidante por su localización en todos los órganos y tejidos, como parte del sistema antioxidante del glutación, por lo que está involucrada en las alteraciones funcionales del organismo que son causa de varias enfermedades (Cisneros y cols., 1997). Cabe considerar, además, que en condiciones de congelamiento, los productos de la oxidación de los componentes lipídicos interactúan con las proteínas, llevando a la desnaturalización de éstas, pérdida nutricional, modificación de perfiles de electroforesis de las proteínas, y pérdida de sistemas endógenos de antioxidantes, como GSH - Px (Aubourg, 2004).
Se conoce que los L - OOH son tóxicos en los tejidos animales y que dan lugar a especies reactivas al oxígeno (ROS) como los radicales peróxido (L-OO*), que son compuestos indeseables para los organismos vivos (Cisneros y cols., 1997), por lo tanto las células de los mamíferos elaboran mecanismos de defensa para eliminar radicales (Figura 3).
Las etapas metabólicas clave son la catálisis de superóxido de dismutasa (SOD), de la dismutación de superóxido a peróxido de hidrógeno y oxígeno, y la conversión de H₂O a 2H₂O por GSH - Px, o a O₂ + H₂O por catalasa.

La reacción catalizada por GSH – Px, es importante para la detoxificación de ROS₂, las que pueden reaccionar con sulfhidrilo (cisteina) o aminoácidos básicos (histidina, lisina), modificando tanto la estructura como la función de las proteínas. La oxidación de las proteínas catalizada por metales conduce a la adición de grupos carbonilos o entrecruzamiento o fragmentación de proteínas (San Miguel y cols., 2006).
La catalasa ha sido por largo tiempo considerada la enzima con mayor responsabilidad para reducir peróxido de hidrógeno (Little y cols, 1970), sin embargo, y según Cohen y Hochstein (1963) la GSH - Px protegería de mejor forma a los eritrocitos de la oxidación a metamioglobina causada por peróxido de hidrógeno. A partir de estos resultados, los autores antes mencionados sugirieron que la GSH – Px puede ser la primera línea de defensa contra el daño oxidativo por peróxido de hidrógeno o peróxido de lípidos producidos en diversas células animales.
Por otro lado, Cisneros y Cols. (1997) afirman que la GSH - Px y la glutación reductasa (GRd) se encuentran formando parte de un sistema antioxidante (GSH – Px / GRd), y la catalasa de otro (SOD / CAT) y han observado que ambos sistemas no actúan a la par; la catalasa actúa en presencia de altas concentraciones de H₂O₂ y la GSH - Px lo hace a concentraciones bajas, lo que se refleja en una correlación inversa en la actividad de ambas enzimas.

Figura 3: Mecanismo de defensa frente al daño por ROS.
1.3.3. Metaloproteinasas
Las metaloproteinasas (MMP’s) constituyen una familia de más de 21 endopeptidasas dependientes de zinc (Alaniz y cols., 2003), que son capaces de degradar diversos componentes de la matriz extracelular (ECM) y de la membrana basal (Aguilar, 2004). En conjunto tienen la capacidad de degradar todos los componentes de la pared arterial y además juegan un papel importante en los sucesos fisiológicos y patológicos que dan lugar a la degradación de la ECM (Peña, 2001). Así, el papel biológico de estas enzimas hidrolíticas de proteínas es esencial dada su capacidad de ruptura del colágeno y de otras proteínas que conforman el tejido conectivo, que hacen posible importantes consecuencias como la remodelación continua de órganos y tejidos (Lozano, 1999).

Las MMP’s son sintetizadas como zimógenos o pro-enzimas inactivas, se clasifican de acuerdo a sus características funcionales y estructurales. Por su funcionalidad y según el sustrato que son capaces de degradar pueden ser agrupadas en: colagenasas, gelatinasas, estromelisinas o matrilisinas, como se muestra en la Figura 4 (Alaniz y cols., 2003).
El músculo de pescado está dividido en bloques de células musculares separadas en miotomo, mediante tejido conectivo denominado miocomata. Cada célula muscular está rodeada por tejido conectivo que se une a la miocomata al final de la célula mediante finas fibras de colágeno. Es allí donde se observa un deterioro, presumiblemente debido a la acción de las enzimas colagenasas autolíticas (FAO, 1999), el cual se ve reflejado en la medición instrumental de la textura del músculo de trucha refrigerada, el cual decae a medida que se solubilizan los niveles de colágeno (Sato y cols., 1991).
La familia de enzimas MMPs, comparten una estructura similar en sus dominios. Todas las enzimas de esta familia de zinc y al menos un ion de poseen en común los siguientes: Péptido señal: es la secuencia responsable de la secreción de la molécula, no está presente en la forma inactiva de la enzima (Peña, 2001).
Dominio proteolítico o catalítico: contiene 2 iones de calcio. Uno de los iones de zinc está presente en el centro activo e implicado en el proceso catalítico de las MMPs. El segundo ion de zinc, también denominado zinc estructural, y el ion de calcio están presentes en el dominio catalítico. El ion de zinc catalítico es esencial para la actividad proteolítica de las MMP’s (Peña, 2001).

Figura 4: Estructura de las MMP’s
Dominio propéptido: consiste en 80-90 aminoácidos que contienen un residuo de cisteina el cual interactúa con el átomo de zinc del dominio catalítico a través de un grupo tiol.
En este dominio hay una secuencia altamente conservada.
La proteólisis de este propéptido da como resultado la activación del zimógeno. La activación puede darse por la acción de enzimas proteolíticas, agentes mercuriales o el calor (Peña, 2001).