
4. Resultados y Discusión
4.1. Actividad proteolítica
La AP en el músculo de salmón ocho (Oncorhynchus kisutch), fue estudiada para determinar si la variación en la dieta de engorda de los individuos, es decir, la adición de antioxidantes naturales, ejercía efecto sobre la conservación de la estructura de las proteínas del salmón, durante el almacenamiento a una temperatura de -18° C por un período de 18 meses. Los resultados se muestran en la Tabla 1.
Tabla 1: Actividad Proteolítica para músculo de Salmón coho almacenado congelado (-18° C) por 18 meses

( ) desviación estándar.
a b c Indican si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de AP de individuos alimentados con la Dieta I o Control.
d Indica si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de AP de individuos alimentados con la Dieta II (Exceso de tocoferoles)
e f Indican si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de AP de individuos alimentados con la Dieta III (Extracto de Romero)
r s t u v w x y z indican si existen o no diferencias significativas con un 95 % de confianza entre las dietas para los valores de AP en los respectivos tiempos.
Los resultados anteriores fueron obtenidos a partir de muestras de 5 individuos para cada tiempo de análisis, realizando 3 réplicas en cada uno de ellos.
Para estudiar si hubo diferencias estadísticamente significativas, a estos valores se les realizó un análisis estadístico para determinar si el valor de AP de las réplicas para cada individuo es o no promediable. Este expresó que no existen diferencias estadísticamente significativas con un 95% de confianza entre las réplicas, entonces las réplicas son promediables.
Se realizó nuevamente un análisis estadístico para determinar si existían o no diferencias significativas, con un 95% de confianza entre los individuos, considerando esta vez el promedio de las réplicas. Se obtuvo entonces un valor p > 0,05 para las muestras extraídas de individuos alimentados con las tres dietas en estudio: Dieta I o Control, Dieta II (Exceso de Tocoferoles) y Dieta III (Extracto de Romero) (Anexo 10). Por lo tanto, los individuos no presentaron diferencias estadísticamente significativas, por lo cual se promediaron y los resultados se expresaron como la media de los 5 individuos con su respectiva desviación estándar (Tabla 1).
Cabe destacar que existió una gran variabilidad en el valor de AP entregado por los individuos, expresada en la alta desviación estándar, lo cual es consistente con los valores expuestos por Hultmann y Rustad (2004) que reportaron desviaciones estándar hasta 4 veces mayor que la media de las muestras analizadas en el caso de Salmón atlántico. Esta alza pudo deberse a características propias de los individuos medidos en ese período, ya que el músculo de pescado está sujeto a diversas variaciones estacionales como pH, grasa, cantidad de agua y proteína que pueden influenciar propiedades funcionales y de procesamiento (Pérez – Borla y cols., 2002). Además, un inadecuado manejo post – captura induce la actividad de enzimas endógenas y la autolisis del músculo (Pacheco – Aguilar y cols., 2000).
Al analizar los individuos alimentados con cada una de las dietas de forma independiente, se realizó el análisis estadístico del comportamiento de AP en el tiempo.
Este indicó que entre los valores de AP de las muestras extraídas de individuos alimentados con la Dieta I o Control, existen diferencias estadísticamente significativas (p ≤ 0,05) durante el tiempo de almacenamiento congelado a – 18° C. Los resultados obtenidos por los análisis estadísticos, indicaron la formación de dos grupos con una AP homogénea en el tiempo, el primero incluyendo los meses 0, 3, 12 y 18, y el segundo los meses 6 y 9.
Los resultados anteriores fueron correlacionados con otros parámetros que representan propiedades físicas y sensoriales del salmón (Latorre, 2007). Se encontró que la variación de AP en el tiempo, para individuos alimentados con la Dieta I o Control, se encuentra directamente relacionada con el porcentaje de agua perdida (Driping cocido), presentando un índice de correlación de Pearson de 0,8182 (Figura 6) , es decir, que al aumentar la AP del músculo de salmón, éste pierde una mayor cantidad de agua al ser sometido al proceso de cocción.
El aumento del “driping” en salmón congelado/descongelado es consistente con la disminución de la capacidad de retención de agua debido a la desnaturalización de las proteínas miofibrilares de las fibras musculares, daño celular, menor solubilidad y agregación de las proteínas que tiene lugar durante la congelación y descongelación (Einen y cols.,2002), lo cual es congruente con el aumento de la AP ya que las proteínas del músculo, importante característica de calidad, tal como sus propiedades texturales, al ser afectadas por enzimas proteolíticas son degradadas. La mayoría de las proteínas pierde su función cuando está desnaturalizada afectando por ende su óptimo funcionamiento y sus propiedades físico-químicas, por lo cual se observan cambios en la textura del músculo (Hultmann y Rustad, 2004).
Se trabajó de manera similar con las muestras provenientes de individuos alimentados con la Dieta II (Exceso de Tocoferoles). El análisis estadístico indicó que no existen diferencias estadísticamente significativas (p > 0,05) en el comportamiento de AP durante el tiempo de almacenamiento congelado a – 18° C.

Figura 6: Correlación entre Actividad Proteolítica y Porcentaje de agua perdida (Driping cocido) en músculo de salmón ocho almacenado congelado (-18° C) por 18 meses
Al comparar los resultados anteriores con propiedades físicas y sensoriales del salmón (Latorre, 2007), no se observó correlación directa o inversa entre los parámetros analizados para los valores de AP de las muestras extraídas de individuos alimentados con la Dieta II (Exceso de Tocoferoles).
El análisis estadístico para el comportamiento de AP de las muestras obtenidas de individuos alimentados con la Dieta III (Extracto de Romero), presentó diferencias estadísticamente significativas, con un 95% de confianza en la AP durante el tiempo de almacenamiento congelado a – 18° C. Estadísticamente se observa la formación de dos grupos entre los tiempos, donde claramente es el mes 9 el que varía con respecto a los otros (Tabla 1). Debido a que las muestras de músculo de salmón coho alimentado con la Dieta III (Extracto de Romero) en el noveno mes de almacenamiento, presentaron una AP notoriamente mayor con respecto a las otras dietas y meses en estudio, se repitió el análisis para ese punto en específico, obteniéndose resultados del mismo orden. La diferencia de AP en este punto puede deberse a la alta variabilidad entre los individuos, situación comentada anteriormente y reflejada en la alta desviación estándar que reportó Hultman y Rustad (2004) o a un mal manejo al momento de almacenar las muestras a -18° C, entre otros factores.
Al comparar los valores de AP de las muestras obtenidas de individuos alimentados con la Dieta III (Extracto de Romero), con propiedades físicas y sensoriales del salmón (Latorre, 2007), se encontró una correlación directa con el recuento de aerobios mesófilos (RAM), expresado como (UFC/G), con un índice de correlación de Pearson de 0,9783 (Figura 7). Esto concuerda con estudios que expresan que entre las posibles fuentes de AP en el músculo se encuentran las enzimas secretadas por bacterias y parásitos que lo invaden (Pacheco-Aguilar y Crawford, 1994).
Se observó que hasta el sexto mes de almacenamiento la AP no presentó diferencias estadísticamente significativas (p > 0,05), por lo que podría asumirse que la adición de antioxidantes naturales a la Dieta II (Exceso de Tocoferoles) y Dieta III (Extracto de Romero) no favorece ni retarda el proceso de AP en el músculo de salmón. Sin embargo, a partir del noveno mes la situación cambia, observándose diferencias significativas (p ≤ 0,05) en la variación de AP durante los últimos meses de almacenamiento, dependiendo de la dieta suministrada a los salmones. Al noveno mes de almacenamiento congelado (-18° C) la AP para las muestras de individuos alimentados con la Dieta III (Extracto de Romero) es mucho mayor que la presentada por individuos alimentados con las otras dietas en estudio. Al doceavo mes, son las muestras de individuos alimentados con la Dieta II (Exceso de Tocoferoles), las que presentan mayor AP y finalmente en el mes 18 de almacenamiento son las muestras de individuos alimentados con la Dieta III (Extracto de Romero) las que presentaron mayor AP.
Al comparar los datos obtenidos para AP en el músculo de Salmón coho, con los valores de AP reportados por Sánchez (2002), para otras especies como el Pejegallo y Tollo Silvestre, en las mismas condiciones de almacenamiento, estos son similares hasta el sexto mes de almacenamiento.
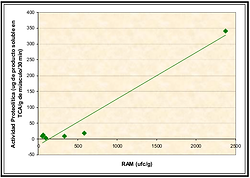
Figura 7: Correlación entre Actividad Proteolítica y Recuento de Aerobios Mesófilos en músculo de Salmón coho almacenado congelado (-18° C) por 18 meses
La actividad inicial para las muestras obtenidas de músculo de salmón ocho alimentado con las Dietas I o Control, II o (Exceso de Tocoferoles) y III (Extracto de Romero) 6,65, 20,41 y 8,39 (μg de producto soluble en TCA/g de músculo/30 min.), respectivamente, fue menor a la determinada en Tollo, 48,62 (μg de producto soluble en TCA/g de músculo/30 min.), pero mayor a la del Pejegallo, 1,14 (μg de producto soluble en TCA/g de músculo/30 mín.).
Valores de iniciales de AP para Salmón atlántico (Salmo salar) 0,05 y 0,08 (mg de péptido soluble liberado TCA/gramo/hora) para pH 6 y 6,5 respectivamente, reportados por Hultmann y Rustad (2004) son mayores que los encontrados para AP en músculo de Salmón coho en cada una de las tres dietas analizadas: 0.0133, 0.0408, 0.0168 (mg de péptido soluble liberado TCA/g/h) para las muestras de individuos alimentados con las Dietas I o Control, II o (Exceso de tocoferoles) y III (Extracto de Romero) respectivamente.
4.2. Glutatión peróxidasa
La Glutatión Peróxidasa (GSH - Px) es una enzima que cataliza la reducción de peróxido de hidrógeno H₂O₂ o L-OOH, utilizando como agente reductor el GSH. Es una enzima que desempeña un importante papel en la defensa antioxidante por su localización en todos los órganos y tejidos, como parte del sistema antioxidante del glutatión. Ha sido reportada en tejidos como eritrocito humano, pulmón e hígado de rata e inclusive en músculo, piel y hepatopáncreas de los peces, por lo que aparenta ser una enzima universal (Cisneros y cols., 1997).
El mecanismo de esta enzima (Figura 9), parte del sistema antioxidante GSH. Px/GRd se desarrolla a partir de la GRd, enzima dependiente del nicotinamín adenín dinucleótido fosfato reducido (NADPH) que cataliza la reducción del glutatión oxidado (GSSG) a GSH, el cual será utilizado por la GSH – Px para la reducción del H₂O₂ y de L-OOH, los cuales son elementos tóxicos (Cisneros, 1995)

Mediante la realización de ensayos previos, se montó el método para la determinación de la actividad de la enzima GSH – Px en músculo de salmón.
En primer lugar se determinó el comportamiento de la enzima frente a distintas cantidades de H₂O₂ en la mezcla a reaccionar. Se mantuvo constante las cantidades de los otros componentes en la mezcla y se modificó la cantidad de H₂O₂ en 100, 50 y 30 μl (Tabla 2).
El análisis estadístico indicó que la cantidad de H₂O₂ adicionado a la reacción tuvo una influencia estadísticamente significativa (p ≤ 0,05) sobre los valores de absorbencia obtenidos, además hubo diferencias entre las todas las cantidades de H₂O₂ utilizadas (100, 50 y 30 μl).
Figura 9: Mecanismo de la enzima glutatión peróxidasa
Con respecto al H₂O₂, como sustrato de ésta reacción enzimática, cabe destacar que existen al menos 3 formas de GSH - Px selenio dependientes: una forma intracelular o celular (GSH – Px - C), una extracelular o plasmática (GSH – Px - P) y otra con actividad específica para los fosfolipoperóxidos (GSH – Px - PH) que por lo general está asociada a la membrana y aunque su actividad es la misma, poseen diferencias en estructura y afinidad. La GSH – Px - c tiene mayor afinidad por el H₂O₂ que por los L-OOH, en tanto la GSH – Px - p tiene una afinidad semejante para los 2 sustratos. La GSH – Px - c y la GSH – Px - p utilizan como sustratos los H₂O₂ y los L-OOH; sin embargo, no son capaces de utilizar los fosfolipoperóxidos (PHL-OOH) que son los sustratos principales para la GSH – Px – PH (Cisneros y cols., 1997).
La presencia de diferentes formas de GSH – Px, las cuales poseen distinto grado de afinidad por el H₂O₂ como sustrato, podría explicar en cierta forma la diferencia de actividad entre los individuos.
De igual forma, se determinó cómo se comportaba la enzima utilizando distintas cantidades de GRd, la cual permite mantener concentraciones de GSH en la célula no sólo para ser utilizado por la GSH - Px en la eliminación del H₂O₂. Este GSH es de utilidad en la recuperación de las vitaminas C (ácido ascórbico) y E (alfa-tocoferol) luego de participar en la eliminación de radicales libres generados in situ o a distancia.
El GSH interviene además en la detoxificación de compuestos xenobióticos, el almacenamiento y transporte de cisteína, la regulación del balance redox de la célula, el metabolismo de los leucotrienos y las prostaglandinas, la síntesis de los 26 desoxirribonucleótidos, la función inmunológica y la proliferación celular (Cisneros, 1995).
Tabla 2: Comportamiento de Glutatión Peróxidasa frente a la cantidad de H₂O₂

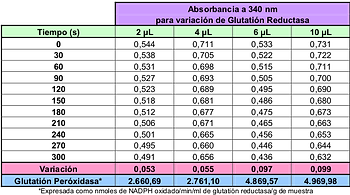
Se modificó entonces la cantidad de GRd adicionado a la mezcla, variando esta en 2, 4, 6 y 10 μl, se mantuvo constante los otros reactivos involucrados (Tabla 3).
El análisis estadístico indicó que la cantidad de GRd tuvo una influencia estadísticamente significativa (p ≤ 0,05) sobre los valores de absorbencia obtenidos.
Sin embargo se observó la formación de un grupo homogéneo entre las absorbencias obtenidas cuando se agregó 4 y 10 μl de GRd a la reacción).
Por último se modificó la cantidad de muestra, extracto enzimático que representa a la GSH – Px en la reacción, en 50, 100 y 150 μl dentro de la mezcla a reaccionar (Tabla 4).
El análisis estadístico indicó que la cantidad de muestra (GSH – Px) tuvo una influencia estadísticamente significativa (p ≤ 0,05) sobre los valores de absorbencia obtenidos.
Cabe destacar que el aumento de la actividad no se comportó directamente proporcional a la cantidad de muestra adicionada.
Considerando los tres ensayos anteriores, y a pesar de que los resultados no fueron los esperados para el comportamiento de la enzima, se decidió realizar los estudios de cuantificación de la enzima en el músculo de Salmón coho con las tres dietas en estudio.
Tabla 3: Comportamiento de Glutatión Peróxidasa frente a la cantidad de GRd
( ) desviación estándar.
a Indican si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de GSH - Px de individuos alimentados con la Dieta I o Control.
b Indica si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de GSH - Px de individuos alimentados con la Dieta II (Exceso de Tocoferoles)
c d Indican si existen o no diferencias significativas con un 95 % de confianza entre los meses de almacenamiento para los valores de GSH - Px de individuos alimentados con la Dieta III (Extracto de Romero)
s t u v w x y z indican si existen o no diferencias significativas con un 95 % de confianza entre las dietas para los valores de GSH – Px en los respectivos tiempos.
La presencia de GSH – Px en el músculo de Salmón coho, fue estudiada para determinar si la variación en la dieta de engorda de los individuos, es decir, la adición de antioxidantes naturales, ejercía efecto sobre los mecanismos propios de defensa antioxidante del salmón, durante el almacenamiento a una temperatura de -18° C por un período de 18 meses (Tabla 5).
Se obtuvo los resultados anteriores a partir de 5 individuos para cada tiempo. Se realizó un análisis estadístico de dos vías, tiempo e individuos, el cual expresó que no existían diferencias estadísticamente significativas, con un 95% de confianza, para los valores de actividad de la enzima GSH – Px de individuos alimentados con todas las dietas en estudio, con respecto a los individuos, lo cual indica que para las tres dietas analizadas los individuos son promediables.
Tabla 4: Comportamiento de Glutatión Peróxidasa al variar la cantidad de ésta en la mezcla reactante
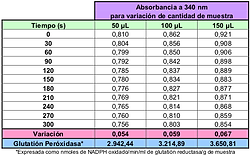
Tabla 5: Actividad de glutatión peróxidasa para músculo de Salmón coho almacenado congelado (-18° C) por 18 meses

Luego se analizó el comportamiento de la enzima GSH – Px de forma independiente para cada una de las dietas en estudio.
El análisis estadístico para la actividad de esta enzima en muestras extraídas de individuos alimentados con la Dieta I o Control indicó que no existían diferencias estadísticamente significativas (p > 0,05) 29 en la actividad de la GSH - Px durante el tiempo de almacenamiento congelado a – 18° C.
Además se realizó una comparación entre los valores de la actividad de la enzima GSH – Px para muestras de individuos alimentados con la Dieta I o Control con propiedades físicas y sensoriales del salmón (Latorre, 2007). En este no se destaca una buena correlación con ninguno de los parámetros analizados.
Luego se realizó una comparación con parámetros indicadores de oxidación lipídica y frescura del salmón (Concha y Vivanco, 2006), encontrándose correlación directa con el índice de peróxidos. Se obtuvo un índice de correlación de Pearson de 0,8746 (Figura 10).
Los peróxidos se encuentran entre los sustratos requeridos para la reacción en la cual participa la GSH - Px, con acción antioxidante, por lo tanto un aumento de éstos aumentaría la actividad de la enzima, a menos que se encontraran en condiciones saturantes en la reacción. Cabe destacar que a mayor cantidad de sustrato, mayor número de centros catalíticos estarán ocupados, lo que incrementará la eficiencia de la reacción, hasta el momento en que todos los sitios posibles estén ocupados. En ese momento se habrá alcanzado el punto de saturación de la enzima y, aunque se añada más sustrato, no aumentará más la eficiencia.
Por su parte, el análisis estadístico de ANOVA de una vía para la actividad de la enzima GSH – Px para muestras de individuos alimentados con la Dieta II (Exceso de Tocoferoles) indicó que no existen diferencias estadísticamente significativas (p > 0,05) en la actividad de esta enzima durante el tiempo de almacenamiento congelado a – 18° C. Se comparó también la actividad de la enzima con propiedades físicas y sensoriales como con parámetros de oxidación lipídica y frescura (Concha y Vivanco, 2006), del salmón.
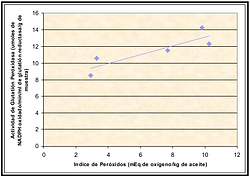
Figura 10: Correlación entre Actividad de Glutatión Peróxidasa e Índice de Peróxidos en Salmón coho almacenado congelado (-18° C) por 18 meses
En ambos casos no se encontró una buena correlación tanto directa como inversa entre la actividad de la enzima y los parámetros antes mencionados.
Finalmente, el análisis estadístico de ANOVA de una vía para el comportamiento de la enzima GSH – Px para muestras obtenidas de individuos alimentados de la Dieta III (Extracto de Romero) indica que existen diferencias estadísticamente significativas (p ≤ 0,05) en la actividad de la enzima durante el tiempo de almacenamiento congelado a – 18° C. Al igual que en los casos anteriores, se correlacionó la variación de la actividad de esta enzima con propiedades físicas y sensoriales (Latorre, 2007) e indicadores de oxidación lipídica y frescura (Concha y Vivanco, 2006) del salmón. En este caso, no se presentó una buena correlación, ni directa ni inversa, en ninguno de los casos anteriormente analizados.
Luego se analizó el comportamiento de las muestras extraídas de individuos alimentados con la Dieta I o Control, con la Dieta II (Exceso de Tocoferoles) y con la Dieta III (Extracto de Romero) en forma conjunta, para todo el período de almacenamiento a -18o C (Figura 11).
Para esto, se realizó un análisis estadístico de ANOVA de una vía con respecto a las dietas en estudio. A tiempo inicial, mes 0, se observan diferencias entre el comportamiento de la enzima de individuos alimentados con la Dieta I o Control y la Dieta II (Exceso de tocoferoles). Esto puede deberse a que los tocoferoles y el selenio actúan sinérgicamente, lo que permite al organismo disponer de su actividad antioxidante aunque no esté disminuido (Benítez, 2006). Esto es de importancia, ya que el selenio es un cofactor para la actividad de la GSH - Px, donde sus deficiencias pudieran inducir modificaciones del estado oxidativo celular y la aparición de enfermedades (Céspedes y Sánchez, 2000).
Al tercer mes de almacenamiento congelado, el comportamiento de esta enzima se presentó como un grupo homogéneo si comparamos las tres dietas en forma conjunta, para que luego al sexto mes la actividad enzimática de las muestras de individuos alimentados con la Dieta III (Extracto de Romero) es significativamente menor con respecto a las otras.
A partir del noveno mes y hasta el final del período de almacenamiento congelado a -18° C, el comportamiento de la enzima no presentó diferencias estadísticamente significativas (p > 0,05), para los individuos alimentados con las tres dietas de engorda, lo que indicaría que no existe una influencia de la adición de antioxidantes naturales a partir de ese mes.
La variación en la actividad de esta enzima puede tener su origen en diversos factores como la hidrólisis de la GSH - Px por el efecto de proteasas intracelulares, la desnaturalización de la enzima por el tiempo y condiciones de almacenamiento (Watanabe y cols., 1996).
4.3. Metaloproteinasas
Las metaloproteinasas (MMP’s) son una familia de proteinasas dependientes de zinc, sintetizadas como zimógenos o pro-enzimas inactivas, que se clasifican de acuerdo a sus características funcionales y estructurales (Alaniz y cols., 2003). Son capaces de degradar componentes de la ECM tales como el colágeno (Woessner, 1991). Por otro lado, es bien conocido que la carne de pescado contiene varios tipos de proteinasas, como serina proteinasas, MMP’s y cisteína proteinasas y la calidad de los productos del mar, como pescado seco – curado, seco - ahumado, y productos a base de surimi, los cuales se ven afectados por estas proteinasas (Saito y cols., 2002).
La relevancia del colágeno en el ablandamiento de la carne de pescado ha sido indicada recientemente al observar que la solubilidad del colágeno aumenta durante el almacenamiento en frío de la carne de pescado (Saito y cols., 2002).
La actividad de MMP’s en el músculo de Salmón coho, fue estudiada para determinar si la variación en la dieta de engorda de los individuos, es decir, la adición de antioxidantes naturales, tienen efecto sobre la degradación del colágeno presente en el músculo de pescado, durante un período de almacenamiento de 18 meses a temperatura de congelación (-18° C).
Se realizó una zimografía para determinar las enzimas MMP’s que se encontraban presentes en las muestras analizadas, las cuales fueron alimentadas con 3 diferentes dietas de engorda (Figura 12).
En la Figura 12, se observa la presencia de actividad gelatinásica en todos los carriles, es decir, en todas las muestras analizadas. La actividad principal se observa en dos posiciones, la primera cercana y bajo los 85 kD y la segunda sobre los 18 kD.
La presencia de esta actividad concuerda con valores reportados por Saito y Cols.
(2002), quienes detectaron actividad cerca de las posiciones 85, 73, 67, 20 y 19 kDa, 110, 85, 73 y 67 kDa y 85 y 67 kD, para extractos provenientes de piel, sangre y músculo de trucha arco iris; destacaron que la sangre aparentemente contiene una mayor cantidad de actividad gelatinásica que otros extractos de tejidos y aquellas provenientes de extractos de músculo fueron ligeramente detectadas.
Debido a la posición de las bandas, presentadas en la Figura 12, se puede asumir que aquella de MM que primero aparece correspondería a MMP-9 o Gelatinasa - B, la cual se observa en un rango de 92 a 84 kD (Westermarck y Kähäri, 1999), perteneciente al grupo de las gelatinasas. Tiene afinidad por la membrana basal (colágeno tipo IV), colágeno desnaturalizado (gelatina), elastina y fibronectina (Bárcenas y cols., 2004).
Las MMP – 9 han sido reportadas como activas en la escisión de colágeno nativo tipo V y desnaturando proteínas de todos los tipos de colágeno. Se cree que la degradación del colágeno tipo V es la causa de la desintegración de las fibras musculares y de ablandamiento muscular (Woessner, 1991). Por lo tanto, estas MMP’s pueden ser los componentes activos que deben ser reprimidos en el músculo de pescado durante el almacenamiento refrigerado (Saito y cols., 2002), ya que el colágeno es el mayor constituyente en el tejido conectivo intramuscular de los peces y como ha sido demostrado, ejerce un importante significado en la textura de la carne (Hatae y cols., 1989).

Figura 11: Actividad de Glutatión Peróxidasa para músculo de Salmón coho almacenado congelado (-18° C) por 18 meses
Carril 1 y 2: Correspondiente a las muestras provenientes de individuos alimentados con Dieta I o Control para el mes 0 y 18 respectivamente.
Carril 3 y 4: Correspondiente a las muestras provenientes de individuos alimentados con Dieta II (Exceso de Tocoferoles) para el mes 0 y 18, respectivamente.
Carril 5 y 6: Correspondiente a las muestras provenientes de individuos alimentados con Dieta III (Extracto de Romero) para el mes 0 y 18, respectivamente.
La segunda banda notoria que se observa con actividad gelatinásica (Figura 12), se encuentra sobre los 18 kD. Una banda similar a esta fue reportada en piel de trucha arco iris (Saito y cols., 2000). Se podría asumir que, debido a la posición en que aparece esta banda, se trataría de MMP – 7, la cual tiene afinidad similar a las gelatinasas (MMP – 2 y MMP – 9). Éstas separan la fibronectina, laminina, elastina y los proteoglicanos (Bárcenas y cols., 2004).

Figura 12: Zimografía que determina presencia de MMP’s en músculo de Salmón coho alimentado con distintas dietas
Esta enzima existe como una forma inactiva, con una masa molecular en un rango de 28 – 30 kD la cual es activada por escisión proteolítica a una forma activa de 19 kD (Fitzgerald Industries Intl., 2001).
Se analizó también la actividad enzimática en las muestras de salmones alimentados con cada una de las dietas de forma independiente. El comportamiento de la Dieta I o Control, Dieta II (Exceso de Tocoferoles) y Dieta III (Extracto de Romero) se observa en la Figura 13, 14 y 15, respectivamente; se observa la variación en el tiempo de las bandas con actividad gelatinásica analizadas anteriormente, banda 1 cercana y bajo 85 kD y banda 2 sobre los 18 kD, durante los 18 meses de almacenamiento congelado.
Se realizó un análisis estadístico de ANOVA multifactorial, para determinar si existían o no diferencias entre la actividad gelatinásica presentada por las bandas con respecto al tiempo. Este determinó que no existían diferencias estadísticamente significativas (p > 0,05) en la variación de la Banda 1, cercana a los 85 kD. En cada uno de los meses de almacenamiento a -18° C, se observó el mismo resultado estadístico para la Banda 2, cercana a los 18 kD.

Figura 13: Comportamiento de la actividad enzimática de MMP’s para individuos alimentados con la Dieta I o Control.
(A) Zimografía correspondiente a individuos durante todo el periodo de almacenamiento. Carril 1: mes 0.
Carril 2: mes 3. Carril 3: mes 6. Carril 4: mes 9. Carril 5: mes 12. Carril 6: mes 18.
(B) Análisis computacional de la variación de las bandas con actividad gelatinolítica durante todo el período de almacenamiento.
STD – MM: Estándar de Masa Molecular en kD.

Figura 14: Comportamiento de la actividad enzimática de MMP’s para individuos alimentados con la Dieta II (Exceso de Tocoferoles)
(A) Zimografía correspondiente a individuos durante todo el periodo de almacenamiento. Carril 1: mes 0.
Carril 2: mes 3. Carril 3: mes 6. Carril 4: mes 9. Carril 5: mes 12. Carril 6: mes 18.
(B) Análisis computacional de la variación de las bandas con actividad gelatinolítica durante todo el período de almacenamiento.
STD – MM: Estándar de Masa Molecular en kD.

Figura 15: Comportamiento de la actividad enzimática de MMP’s para individuos alimentados con la Dieta III (Extracto de Romero)
Se determinó también que no existían diferencias entre la variación de la actividad enzimática de la Banda 1, con respecto a las dietas de engorda, a diferencia de lo ocurrido con la Banda 2, donde la variación en la actividad enzimática presentada por los individuos alimentados con la Dieta II (Exceso de Tocoferoles) mostró diferencias con respecto al comportamiento de las otras dos dietas en estudio. La Dieta II (Exceso de Tocoferoles), durante los primeros meses de almacenamiento no mostró actividad en la Banda 2 (Figura 14), o por lo menos esta no es detectada tanto al observar el gel como por el programa computacional utilizado, esto la diferencia con las otras dos dietas en estudio que presentaron actividad durante el periodo de tiempo mencionado.
La actividad enzimática de MMP’s provoca la degradación del colágeno, el cual es el mayor constituyente del tejido conectivo intramuscular de los peces, ejerciendo una importante función en la textura de su carne (Sato y cols., 1986; Hatae y cols., 1986), por lo cual es de importancia correlacionar la variación de la actividad presentada por esta enzima en el músculo de Salmón coho, con otras propiedades del salmón (Latorre, 2007). Así, mediante un análisis de correlación de Pearson, se logró correlacionar, para los individuos alimentados con cada dieta por separado, la actividad gelatinásica con propiedades físicas y sensoriales del salmón.
Para aquellas bandas provenientes de individuos alimentados con la Dieta I o Control, cabe destacar una correlación positiva de la banda 2 con “gaping” (Figura 16).
El “gaping” corresponde al grado de separación espontánea de los miómeros en el filete, lo cual dificulta su posterior procesamiento y disminuye su valor comercial (Skjervold y cols., 2002). El colágeno es el principal constituyente de la matriz, la cual es la responsable de la integridad del miocomata, láminas de colágeno (Nurshall, 1956), y las propiedades mecánicas del músculo (Delbarre-Ladrat y cols., 2006). Por lo tanto, un aumento en la degradación del colágeno presente en el músculo de Salmón coho, facilitaría la separación de los miómeros.

Figura 16: Correlación entre Actividad Gelatinásica de Banda 2 y Gaping en músculo de Salmón coho alimentado con la Dieta I o Control y almacenado congelado (-18° C) por 18 meses
Espe y cols. (2004) Reportaron resultados similares en Salmón atlántico, donde el colágeno insoluble estuvo relacionado con filetes que presentaron “gaping” durante el almacenamiento en hielo. Hallet y Bremner (1985) determinaron que el gaping causado por la degradación de las fibras de colágeno entre la fibra muscular y el miocomata, es el responsable por el ablandamiento del músculo de “hoki” (Macruronus novaezelandiae).
Dentro de las bandas presentadas por los individuos alimentados con la Dieta I o Control, también se presentó una correlación inversa entre las Bandas 1 y 2 con el porcentaje de líquido perdido o “driping crudo” (Figura 17), que corresponde al exudado de líquidos por goteo en pescados que se descongelan (Einen y cols., 2002). Esto podría significar que al aumentar el exudado la pérdida de enzimas en éste aumenta, por lo que disminuiría la cantidad de éstas en el músculo y por ende su actividad.
Para aquellas bandas provenientes de individuos alimentados con la Dieta II (Exceso de Tocoferoles) no se encontró correlación con ninguno de los parámetros analizados anteriormente.
Como se muestra en la figura 18, la Banda 1 proveniente de individuos alimentados con la Dieta III (Extracto de Romero) correlacionaron de forma directa con las unidades formadoras de colonias. En este sentido cabe destacar que diversos microorganismos, especialmente Clostridium, producen colagenasas. Estas enzimas difieren de las colagenasas animales porque degradan extensamente el colágeno (Mahecha y cols., 2007).
Además la Banda 2 obtuvo una buena correlación con el porcentaje de agua perdida, driping cocido (Figura 19), como se mencionó anteriormente, cuando este índice se correlacionó con AP, el aumento del “driping” se encuentra directamente relacionado con la capacidad de retención de agua (Einen y cols.,2002).
Finalmente se correlacionaron los parámetros de AP, GSH – Px, MMP’s y peso de los individuos entre sí. El análisis estadístico determinó que no existe correlación alguna entre los parámetros en estudio para el músculo de Salmón coho alimentado con cada una de las dietas de engorda en estudio.

Figura 17: Correlación entre Actividad Gelatinásica de Banda 1 y 2 y Porcentaje de Líquido Perdido (Driping crudo) en músculo de Salmón coho alimentado con la Dieta I o control y almacenado congelado (-18° C) por 18 meses

Figura 19: Correlación entre Actividad Gelatinásica de Banda 2 y Porcentaje de Líquido Perdido (Driping cocido) en músculo de Salmón coho alimentado con la Dieta III (Extracto de romero) y almacenado congelado (-18° C) por 18 meses

Figura 18: Correlación entre Actividad Gelatinásica de Banda 1 y Nivel microbiológico (ufc) en músculo de Salmón coho alimentado con la Dieta III (Extracto de Romero) almacenado y congelado (-18° C) por 18 meses