
VII. Incubación
Después que han sido fertilizados los huevos, éstos son colocados en las incubadoras. Existen muchos tipos de ellas que han sido diseñadas para huevos pelásgicos y sus modelos van desde los más sencillos, hasta aquellas que tienen una gran capacidad de almacenaje.
7.1 Incubadoras tipo "Zoug"
El uso de estas incubadoras se inició en 1971, cuando se logró la reproducción inducida de la carpa herbívora (Rosas, 1983).
.jpeg)
En esa época se adecuaron recipientes de vidrio con una capacidad de 20 litros, basados en el principio de las incubadoras tipo "Zoug", cuyo nombre deriva del Lago Zoug en Suiza, lugar donde fueron utilizadas por primera vez (Woynarovich y Horvath, 1981).
El funcionamiento de estos artefactos es el siguiente: el agua se suministra a través de un tubo en la parte inferior y más angosta del recipiente, que se conecta a un dispositivo que tiene perforaciones para que el agua se distribuya en forma homogénea y provoque de esta forma un conocimiento continuo de los huevos, con lo que además, se pretende favorecer el aporte constante de oxígeno y la eliminación de los materiales de desecho, fluyendo el agua hacia la parte superior.
Este sistema presenta algunos inconvenientes, dentro de los cuales se desplazan: una baja capacidad de recepción de huevos, ya que su carga máxima es de 15,000. Los huevos se acumulan en el fondo del recipiente y permanecen sin movimiento y por último se requiere de un cuidado intensivo sobre todo cuando se realiza la eclosión con el fin de mantener limpia la cubierta de protección y evitar la salida de los alevines (Figura 3).
En principio, durante la primera fase de la incubación, los requerimientos de oxígeno para los huevos son bajos y se necesita un flujo de .5 a .7 litros por minuto.
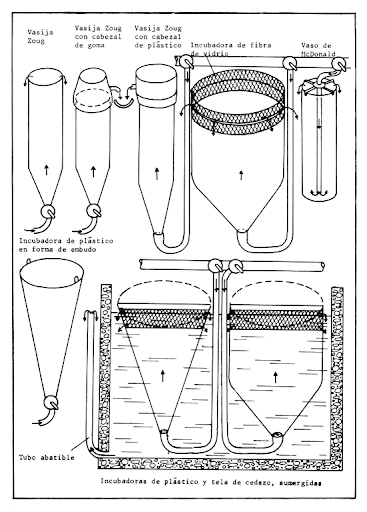
Esto da ciertas ventajas ya que los huevos hasta la fase de gástrula son muy sensibles a los impactos causados por una fuerte turbulencia, que puede dar como resultado serias pérdidas. Después de las 12 a 14 horas, la demanda de oxígeno por parte del embrión se incrementa gradualmente y el flujo de agua debe mantenerse entre 2.5 y 3 litros por segundo.
7.2 Incubadoras 'Weiss'
En 1975, se trajeron a México seis incubadoras 'Weiss" procedentes de la República de Cuba, fabricadas en material acrílico que durante cinco años fueron utilizadas intensivamente y que plantearon una solución parcial al problema de incubación de huevos pelágicos.


Figura 3

Figura 5

Figura 4
7.3 Otros tipos de incubadoras
También han sido probados otros tipos de incubadoras, como las fabricadas a base de lona, que pueden ser instaladas en pequeños estanques, arroyos o en canales con circulación continua de agua. Su volumen fluctúa entre los 50 y 70 litros pero adolece de numerosos inconvenientes debido a que tiene que ser adaptado a las condiciones prevalecientes en la zona, lo
que trae consigo una baja eficiencia en la incubación de los huevos (Figura 5).
En la Unión Soviética, se utilizan los aspectos llamados Vniiprkh, con una capacidad que fluctúa entre los 50 y 200 litros (Tabla 6).
Tabla 6. Diferentes tipos de incubadoras Vniiprkh

Para un eficiente funcionamiento de estos aparatos se recomienda colocar el producto de una hembra en incubadoras separadas, ya que la fecundidad varía entre 500 y 800 mil huevos, por lo que los aparatos de 100 litros son los más apropiados. También, debido a que existen hembras de alta fecundidad (de más de un millón de huevos) y otras de baja fecundidad, es costumbre utilizar seis aparatos con una capacidad de 100 litros y dos o tres con capacidad de 200 litros, con 10 incubadoras por sección (Anónimo, 1971).
En Israel, actualmente se usan incubadoras cónicas tipo holandés, que tienen una capacidad aproximada de 300 000 huevos. Su forma como su nombre lo indica es cónica con un ángulo en la base de 36° y el agua entra por abajo manteniendo en constante movimiento a los huevos. Se ha observado que la eficiencia de estas incubadoras es mayor cuando el ángulo del cono es más pequeño (Huismen, 1976 y Rothbard, 1981).
.jpeg)
7.4 Incubadoras de canal circulante
Estas incubadoras son utilizadas muy comúnmente en la República Popular China, aunque en la actualidad su uso se ha ido extendiendo a otros países incluyendo a México.
En 1979, como consecuencia de una visita de técnicos mexicanos a la República Popular China, el concepto y el diseño de este tipo de incubadoras fue importado a nuestro país y se construyeron dos de ellas en el Centro Acuícola de Tezontepec de Aldama, Hgo., que para 1980 empezaron a operar y cuyos resultados mostraron un aumento en la eficiencia de incubación en un 150% con un potencial anual de alevines de 45 x 106. (Fotografía 11).
7.4.1 Descripción del sistema
El sistema de las incubadoras de canal circulante consta de tres partes:
a) Tanque de oxigenación y filtrado. Tiene de 2 a 3 m³ de capacidad y su función es favorecer la oxigenación y el filtrado del agua que entra a la cámara de incubación. Por tal motivo en el fondo del mismo se colocan capas de grava y arena, siguiendo un gradiente granulométrico desde la parte superior hasta el fondo (Figura 6 A y B).
Es en esta zona donde quedan almacenadas las impurezas que trae el agua, como es el caso del sedimento y otras partículas. En algunos casos es necesario construir este tanque, sobre todo cuando la fuente de agua proviene directamente del río o un manantial.

Fotografía 11. Aspecto general de las incubadoras de canal circulante instaladas en el centro acuícola de Tezontepec DE Aldama, Hgo.
Para darle mayor resistencia debe llevar de 4 a 6 castillos con una traba en la parte inferior a nivel de piso y una traba en la parte superior. De esta manera soportará mejor la presión ejercida por el volumen de agua que contiene. Es recomendable un aplanado muy fino de concreto siendo necesario pulirlo perfectamente, procurando que no queden superficies ásperas que puedan dañar a los huevecillos. Es conveniente la aplicación de pintura épica (varias capas) con el fin de asegurar un periodo más largo de vida de la construcción. El grosor de esta pared es de 15 cm (Figura 6, A, B y C).respectivamente. Para darle mayor resistencia debe llevar de 4 a 6 castillos con una traba en la parte inferior a nivel de piso y una traba en la parte superior.
En el fondo del tanque se instala un tubo para conducir el agua a la cámara de incubación. Este puede ser de PVC, cobre o asbesto, debiendo tener una válvula para el paso del agua a las incubadoras. La diferencia de nivel entre el piso del tanque y la parte más alta de la cámara de incubación debe ser de un metro como mínimo, para asegurar una presión adecuada.
b) Cámara de incubación o canal circulante. Puede ser de forma ovalada aunque la más común es la de forma circular. Su tamaño no varía de 3 a 4 m de diámetro y 1 m de profundidad. Este tipo de incubadora puede construirse también con dos o más canales circulantes por lo que pueden ser monocirculantes, bicirculantes o multicirculantes (cámaras múltiples). Cada una de ellas se construye concéntricamente a las otras.
Sus componentes son:
1. Pared circulante exterior. Es construida de tabique unido con una mezcla de arena y cemento en una proporción de 3 a 1 respectivamente.
De esta manera soportará mejor la presión ejercida por el volumen de agua que contiene. Es recomendable un aplanado muy fino de concreto siendo necesario pulirlo perfectamente, procurando que no queden superficies ásperas que puedan dañar a los huevecillos. Es conveniente la aplicación de pintura épica (varias capas) con el fin de asegurar un periodo más largo de vida de la construcción. El grosor de esta pared es de 15 cm (Figura 6, A, B y C).
2. Pared circular interior. Esta estructura se construye a base de concreto armado. Posee una especie de ventanas con ranuras por donde entra un marco de madera, al cual va fijada una malla de plástico de 3 milímetros de luz.

Figura 6. Plano estructural de las incubadoras de canal circulante
Esta malla actúa como filtro ya que permite el paso del agua utilizada hacia el tubo de desagüe e impide la salida de los huevecillos y/o de los alevines. (Fotografía 12).
3. Tubos de entrada de agua tipo "Pico de pato". Estos tubos van colocados en el piso de la cámara de incubación, esto es, entre la pared exterior y la interior. Tienen una orientación tangencial a la pared interior para distribuir uniformemente el agua y mantener a los huevecillos y/o alevines en movimiento constante. Van conectados al tubo que viene del tanque de oxigenación y filtrado y son 5 en total. Tienen forma aplanada, de ahí que reciben el nombre de "Pico de pato".
4. Tubos de desagüe y de vaciado de la incubadora. Este sistema consta de 1 tubo de desagüe (rebosadero), el cual va colocado dentro del espacio circular de la pared interior de la incubadora y es el que mantiene el nivel general del agua. A un lado de este tubo se encuentra otro llamado de prevaciado que tiene como función bajar el nivel del agua de la incubadora hasta 50 cm de altura. Un tercer tubo va situado en el piso del canal circulante. Se utiliza para vaciar completamente el sistema y es el que conduce a los alevines a la pileta de recepción.
Es importante señalar que la razón por la que existe un tubo de prevaciado y uno de vaciado total es con el fin de bajar lentamente el nivel del agua y evitar de este modo que la presión sea tan fuerte que ocasione pérdidas considerables de organismos.
c) Pileta de recepción de alevines. El nivel superior de esta pileta se localiza por arriba del tubo de vaciado total. Mide 6 m de largo por 2 m de ancho por 1.20 m de profundidad.

Fotografía 12. Vista superior de una incubadora de canal circulante, donde se muestra la pared circular exterior, la cámara de incubación y la pared circular interior
Posee una compuerta ahogada de altura regulable por medio de agujas o tablas de madera. Para vaciar la incubadora es necesario llenar completamente esta pileta quedando el tubo de vaciado total por abajo del nivel de agua de la misma y así eliminar el riesgo de lastimar a los alevines.
Para concentrar a los organismos y poder manejarlos fácilmente se instala un corral de tela de organza dentro de la pileta, con una boca que va conectada directamente al tubo de vaciado.
Ahora bien, se deben colocar válvulas para controlar el flujo de agua en cada una de las partes que componen al sistema. La primera debe estar localizada en la entrada del agua al tanque de filtrado. La siguiente se coloca en el tubo que va del tanque de filtrado a la incubadora. Esta reviste gran importancia ya que regula la cantidad de agua que entra a la cámara de incubación, dejando pasar únicamente el volumen que se necesita dependiendo de la fase del estado embrionario.
7.4.2 Ventajas
En primer lugar, hay que señalar la enorme capacidad de almacenamiento de huevecillos que presenta, ya que puede llegar a albergar hasta 5 millones, por lo que su poder de producción es significativamente superior a todos los sistemas mencionados al principio de este trabajo.
Los porcentajes de eclosión varían de acuerdo a las técnicas utilizadas para desovar los reproductores, siendo generalmente de un 65-80%, siempre y cuando la fecundación se realice manualmente.
Por otro lado, no es necesaria la vigilancia permanente de la incubadora, en vista de que funciona constantemente por medio de válvulas que regulan el flujo manteniendo los niveles adecuados.
Después de la eclosión de los alevines, estos pueden mantenerse almacenados durante un lapso comprendido entre los 6 y 7 días; al término del cual los organismos deben extraerse, ya que de lo contrario se empezará a observar una mortandad progresiva debido a la insuficiencia de espacio e ingestión de alimento natural.
7.4.3 Limpieza y mantenimiento
a) Limpieza
Inmediatamente después de que la incubadora es vaciada, se procede a lavar perfectamente las partes que la integran, utilizando cepillos y agua en abundancia para eliminar los residuos e impurezas que pudieran haber quedado.
b) Mantenimiento

Se proporciona solamente una vez al año y consiste en pintar completamente el interior y exterior de la incubadora, además de cambiar, en caso de estar deteriorada, la malla de plástico que va fijada a los marcos de madera que actúan como filtro.
Es importante señalar que estas incubadoras deben estar techadas para evitar la incidencia directa de los rayos solares sobre los huevecillos, lo que es perjudicial para los mismos, eliminando también con esto la proliferación de algas en las paredes del sistema.

7.5 Eficiencia de las incubadoras
La eficiencia de las incubadoras es determinada por varios factores, entre ellos cabe mencionar la buena fertilización del huevo, que depende en gran medida de la calidad de los reproductores, de los productos sexuales, del manejo de las técnicas de fertilización, la calidad del agua y la operación de los sistemas de incubación.
Entre las recomendaciones para obtener buenos resultados en la incubación se debe:
a) Mantener el nivel y el flujo de agua a una presión adecuada para que se pueda asegurar un suplemento constante.
b) Evitar la salida de huevos y alevines.
c) Mantener un sistema de filtros para evitar depredadores y otro tipo de material que afecte el desarrollo del huevo.
d) Tomar precauciones en la densidad, en el control del flujo, garantizar que el huevo flote libremente y en forma lenta para evitar que se dañe.
e) Como una medida preventiva, se recomienda preparar otras incubadoras, por si se presentan problemas con el flujo de agua, en caso de que esto suceda los huevos deben ser trasladados inmediatamente (Amiritmo, 1978).
En otros casos también se recomienda retirar los huevos muertos, después de que ha sido completado el proceso de gastrulación, casi siempre éstos se hidratan más y se observan como una capa blanca, por arriba de los huevos vivos.
Realmente existen pocos estudios que evalúen con precisión la eficiencia de las incubadoras, ya que las variaciones en el flujo de agua y la temperatura provocan altas mortandades. Al respecto, algunas experiencias desarrolladas en Tezontepec en las incubadoras de "canal circulante", han demostrado que al colocar los huevos recién fecundados, éstos se van al fondo del canal, para subir a las 3 o 5 horas después y distribuirse homogéneamente en la columna de agua, pero esto puede ser prevenido esperando a que el huevo se hidrate antes de ser colocado en la incubadora.
La concentración no es regular ya que los huevos muertos se agrupan en la superficie, lo que obedece a que tienen una menor densidad por la pérdida y destrucción del embrión, para después de un tiempo reventar, siendo afectados por hongos y por lo tanto deben de ser extraídos para evitar infecciones a los huevos vivos.
El porciento de mortalidad relativa en tres especies de carpas chinas (cabezona, plateada y herbívora) a un flujo de 0.83 lt/seg, fue más alta en la carpa plateada (90%), siendo más crítica a partir del estado de desarrollo VIII, que es cuando comienza el estado de blástula (a las 5 horas después de la fecundación) y alcanzando un máximo en el estado XVIII a las 25 horas de edad, para después decrecer en forma paulatina, hasta el momento del nacimiento de los alevines que se sucedió aproximadamente a las 31 horas (a una temperatura de 23.0 + .5°C). La carpa cabezona, por otra parte, presenta la mortalidad más baja (60%), iniciándose el punto crítico en el estado VI, que es cuando la hidratación del huevo ha sido terminada y el huevo alcanza un tamaño de 6 mm, el máximo se registró a las 25 horas, cuando el huevo se encontraba en el estado XIX, que es cuando el embrión presenta movimientos regulares y el primordio de la aleta caudal se separa del saco vitelino; a partir de este punto se observa un decrecimiento rápido de la mortalidad, hasta el momento del nacimiento de los alevines, que se sucede a las 37 horas.
Por último, la carpa herbívora mostró un 75% de mortalidad relativa, iniciándose ésta a partir del estado III a los 50 minutos después de la fertilización, que es cuando el blastodisco se divide en ocho blastómeros, aumentando progresivamente hasta el estado XVI, al inicio de la segmentación del mesodermo (a las 15 horas), para mantenerse estable hasta el nacimiento de los alevines, que se da a las 33 horas (Figura 7A, 8 y C).
A medida que se incrementa el flujo en las incubadoras, se observa un incremento gradual de la mortalidad, llegando a alcanzar un valor promedio de 80% a tres flujos: 1.06, 1.09 y 1.45 lt/seg,(63.6, 65.4 y 87.0 lt/min), lo que indica que a medida que se intensifica el movimiento del agua, la mortalidad es mayor, por lo que un flujo de 50 lt/min, es adecuado para disminuir la mortalidad del embrión en desarrollo. La mortalidad en esas condiciones prácticamente se inicia a los pocos minutos después de la fecundación, llegando a un 50% entre los estados X y XII, que es cuando el desarrollo blastular es más avanzado y continua hasta el nacimiento de los alevines entre las 31 y 32 horas. (Figura 8A, 8 y C).
Las altas mortandades registradas en estos sistemas podrían obedecer a diferentes causas entre las que podemos mencionar: las condiciones de los reproductores, manejo genético, calidad de los productos sexuales, deficiencias en el manejo de las técnicas de fecundación, incluyendo los efectos acumulativos de las glándulas pituitarias aplicadas con anterioridad, la calidad del agua, flujo y su variación con respecto al tiempo.
En relación a la calidad del agua de las incubadoras de 'crol circulante" se ha registrado que a lo largo del tiempo de incubación, el pH y la temperatura se mantienen constantes (temperatura 23 + .5°C y pH 7.6 + 1). En el caso del oxígeno disuelto, se ha observado que éste se mantiene sin mucha variación entre 6.1 y 6.8 mg/lt, algunas veces fluctuando desde 7.3 a 6.6 mg/lt, que en ningún momento ponen en riesgo la vida de los huevos en desarrollo. No obstante, se marcan leves diferencias en la columna de agua, presentándose los valores más altos en la superficie y los más bajos en el fondo (Figura 9).

Figura 7. A, B y C Porciento de mortalidad relativa respecto al tiempo y al estado de desarrollo en tres especies de carpas chinas, en incubadoras de canal circulante a un flujo de .83 1/seg.

Figura 8. A, B y C Variación del porciento de mortalidad del huevo de carpa herbívora en función del tiempo, estado de desarrollo del embrión y el flujo de agua en incubadoras de canal circulante
Esta información nos permite ubicar nuevas líneas de investigación que estén orientadas a realizar estudios tendientes a mejorar y optimizar la eficiencia de las incubadoras, permitiendo de esta manera obtener una mayor sobrevivencia del huevo fecundado y en consecuencia una más alta producci6n de alevines.
7.6 Duración del tiempo de incubación
Sin lugar a dudas, su temperatura es el factor principal que determina el desarrollo embrionario del huevo de los ciprínidos asiáticos, ya que de acuerdo con algunos autores (Rothbard, 1981 y Anónimo 1971), el intervalo óptimo se ubica entre los 21 y 25°C, siendo para el caso de las carpas chinas más corto que para la brema y las variedades de la carpa común. (Tabla 7).
En la estación de Tezontepec de Aldama, se ha observado que a una temperatura entre los 22 y 23.5°C, la carpa plateada es una especie que tiene un desarrollo embrionario más rápido (30-31 horas) y las variedades de la carpa común el más largo (49 y 51 horas). El promedio de las carpas chinas es de aproximadamente 33 horas, aunque la duración en que termina la ruptura del huevo se puede prolongar hasta más de tres horas y en estos casos se recomienda incrementar la eclosión reduciendo el flujo de la incubadora de 3 a 5 veces, lo que estimula la segregación de la enzima que rompe su membrana externa del huevo y la ruptura del huevo se acelera a solo unos minutos.
Después de esto, el flujo debe ser colocado a su nivel normal, ya que si se prolonga esta situación, puede ocurrir una mortalidad masiva de alevines; por otro lado, esta técnica es recomendable para obtener una eclosión uniforme, a manera de evitar desviaciones en los índices de crecimiento (Hulata et al., 1976 y WOhlfarth y Moav, 1970).

Figura 9. Variación oxigeno al tiempo de incubación a tres niveles del en la incubadora de canal circulante
Tabla 7. Tamaño del huevo a diferentes estados de desarrollo y tiempo de incubación, en las incubadoras de "canal circulante"
