
Cultivo de microcrustáceos de agua dulce
1. Consideraciones generales
Dentro de esta clase de organismos existen dos géneros de agua dulce de gran importancia en Acuicultura, que son Daphnia y Moina, las cuales se localizan en diversos medios. El género Daphnia comprende más de 20 especies, de las cuales las más conocidas son: Daphnia magna, D. pulex, D. longispina, D. strauss.
En relación al género Moina podemos mencionar a las especies: Moina rectirostris, M. macrocopa, M. brachiata y M. affinis.
1.1) Morfología
Estos organismos se caracterizan por poseer un cuerpo comprimido lateralmente y ovalado (Figura 24); no se distinguen segmentos como en otros crustáceos. Presentan dimorfismo sexual marcado, la hembra es más grande que el macho (Figura 25). Presentan un carapacho de quitina transparente, las antenas o apéndices con numerosas setas; ojos compuestos y simples (ojo nauplio). Una cavidad embriónica con huevos y embriones situados en la parte dorsal, entre el carapacho y el dorso del cuerpo. Para la identificación de especies son importantes los apéndices torácicos en la forma y número de espinas y setas (Figura 24).
2. Parámetros ambientales
2.1) Hábitat
Son organismos ampliamente distribuidos en lagos, reservorios artificiales, charcos temporales y aguas de desecho. Poseen huevos de resistencia llamados efipios con una envoltura quitinosa que el aire y los animales pueden distribuir. Son abundantes en ambientes con alta concentración de materia orgánica en donde proliferan bacterias, levaduras y microalgas. Especies de Daphnia pueden cohabitar con Moina, Copépodos y Braquiópodos.
2.2) Temperatura
D. magna es especialmente resistente a cambios extremos de temperatura desde O°C a 22°C y se consideran 18°C 20°C como su temperatura óptima.
D. longispina, D. pulex y Moina rectirostris no sobreviven a cambios extremos de temperatura, se desarrollan en temperaturas de 28°C – 29°C.
Moina macrocopa se desarrolla también en un rango amplio de temperatura desde 5°C a 30°C y se considera de 24°C – 26°C como su temperatura óptima.
Moina brachiata crece en temperaturas de 8°C – 13°C.
2.3) Requerimientos de Oxígeno
Estos organismos habitan en medios donde la concentración de O₂ es variable, ya que pueden crecer tanto en completa saturación de O₂ hasta concentraciones muy bajas. Estas concentraciones están en relación a temperatura, concentración de materia orgánica, concentración de microalgas, etc. La supervivencia en medios pobres de oxígeno depende de la capacidad de sintetizar hemoglobina. Este fenómeno está en relación directa con el oxígeno ambiental. Un incremento en hemoglobina está en razón directa de alta temperatura y excesiva densidad de población. Incluso la hemoglobina está presente también en los huevos y la síntesis de hemoglobina también está relacionada con la concentración de CO₂ ambiental.

Fig. 23) Daphnia pulex (hembra) Vollmer, 1951
1. Antenula
2. Antena
3. Músculos de las antenas
4. Ojos compuestos
5. Ganglio óptico
6. Músculo del ojo
7. Cerebro
8. Procesos hepáticos
9. Intestino
10. Corazón
11. Ovario
12. Cámara embrionaria
13. Embrios
14. Proceos abdominales
15. Postabdomen
16. Ano
17. Huevo toráxico
18. Saco respiratorio
19. Seta filtradora
20. Carapacho
21. Glándula maxilar
22. Primer par de apéndices
23. Mandíbula
2.4) Requerimientos en pH
El pH óptimo en estas especies es difícil de determinar. En términos generales, el pH oscila entre 7.1 – 8 y por ejemplo en D. pulex el pH óptimo es de 5 a 6.
2.5) Otros Requerimientos
Existe en estas especies una alta sensibilidad a cambios del equilibrio iónico y a diferentes concentraciones de cationes en el medio.
Las reacciones de Daphnia a la presencia de sales de fosfatos y nitratos (0.5 mg/l) es interesante, pues estimula la reproducción y la madurez sexual.
Los huevos contienen carotenoides y su síntesis requiere de la presencia de luz. Es importante mencionar que la madurez sexual también está influenciada por la presencia de luz.

Fig. 24) Estructura de anténulas en macho y hembra de D. magna (Irleva, 1973).
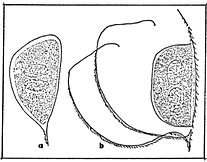
Fig. 25) Huevo de resistencia efipios en D. pulex (a) y D. magna (b). (Irleva, 1973).
La abundancia y distribución de estas especies depende de la variación estacional pues el número y tamaño de huevos de resistencia partenogenéticos y la madurez sexual dependen de las variaciones de T°, S‰, pH y luz, entre otros. Un exceso de luz solar reduce considerablemente una población.
En relación a la producción de huevos Ephippia (Figura 26) (huevos de resistencia partenogenéticos) dependen de la temperatura principalmente. Por ejemplo, en Moina rectirostris éstos se producen a 20~27°C y en M. macrocopa a 14°C.
La alimentación en Daphnia y Moina es más compleja que en Branchiópodos, ya que estas especies se alimentan de bacterias, levaduras y microalgas. La Daphnia se adapta a cambios ambientales y puede adaptarse a ambientes nuevos en tres siete días, reproduciéndose partenogenéticamente. Las colectas de estos organismos de los medios naturales para su cultivo, deben hacerse en Primavera y Verano.
3. Tipos de cultivo
La producción de Daphnia y Moina en condiciones de cultivo es relativamente sencilla por su resistencia a variaciones ambientales y diversas dietas alternativas que se pueden usar como se ha mencionado en párrafos anteriores.
Como en otras especies de alimento vivo, las alternativas de producción de estas especies pueden ser: cultivo en laboratorio para fines de investigación, cultivo intensivo y cultivo extensivo. La Tabla 33 muestra la producción de microcrustáceos de agua dulce con diferentes especies de microalgas y bacterias.
3.1) Condiciones Óptimas de Cultivo
T°C-15°C a 25°C
O₂ - 3 a 6 mg/l
pH-(6.8 – 7.8)
Grado de Oxidación-14.8–26.2 mg O₂ /l
3.2) Medios de Cultivo Recomendables
-
Medios minerales (sales de fosfatos y nitratos)
-
Medios orgánicos (estiércol de caballo, res, cerdo, gallina)
-
Medios enriquecidos (combinación de medios orgánicos e inorgánicos o extractos de suelo
Se recomienda cosechar estos organismos a intervalos regulares para mantener un equilibrio en el cultivo. En condiciones óptimas de cultivo para iniciar la cosecha (de 20 a 25 días después del inicio del cultivo), se puede obtener una biomasa de 10 g/m³. Las Tablas 34 y 35 muestran los diferentes medios de cultivo recomendables para sistemas intensivos y extensivos.
4. Importancia nutricional
Las especies más estudiadas en relación de su aporte nutricional para la Acuicultura son Daphnia y Moina. La Tabla 36 nos muestra el contenido nutricional reportado para Daphnia.
Estas dos especies de cladóceros de agua dulce han sido seleccionadas dentro del grupo de zooplancton que ofrece alto contenido nutricional y facilidades de producción en cultivo.
La Tabla 37 muestra la composición mineral y proximal de cinco especies seleccionadas como alimento vivo; entre éstas se encuentran Daphnia y Moina.
Es importante considerar que el contenido nutricional de estas especies está en función directa del sustrato en el que se desarrollan. La Tabla 5 muestra la composición de aminoácidos esenciales de estas cinco especies seleccionadas; dentro de éstas, Daphnia y Moina tienen un buen aporte.
Los cladóceros en Acuicultura han sido objeto de estudios muy serios en países desarrollados como el Japón y la Unión Soviética. Estos trabajos han permitido conocer las condiciones óptimas para su producción en cultivo masivo, así como las alternativas de producción en diferentes medios de cultivo.
Tabla 34. Producción de microcrustáceos de agua dulce con diferentes alimentos (irleva i.v., 1973)

Tabla 35. Medio de cultivo para “pulga de agua” para sistema intensivo (sepesca-Acuicultura, 1983, com. Pers.)

Tabla 36. Resultados de cultivos de microcrustáceos de agua dulce (cladóceros) con nutrientes orgánicos e inorgánicos-sistemas intensivo y extensivo (Irleva, i.v., 1973)

Tabla 37. Contenido de aminoácidos en daphnia (Irleva I.V, 1973)

Tabla 38. Composición mineral y proximal de cinco especies de alimento vivo seleccionado
