
II. Cultivo de microalgas
Son llamadas microalgas a una gran cantidad de especies que constituyen el fitoplancton que abarca desde organismos autótrofos hasta microflagelados y microciliados auxótrofos.
Su posición taxonómica ha sido de gran polémica entre botánicos y zoólogos, como por ejemplo podemos mencionar el grupo de los dinoflagelados, conocidos por unos como microalgas y por otros como protozoarios.
En este trabajo no pretendemos apoyar o rechazar ninguna de las líneas en relación a la sistemática taxonómica, pero mencionaremos los ejemplos más representativos por su importancia en Acuicultura de acuerdo con la clasificación que se muestra en la Tabla 1, seguida por Guillard, 1973, 1975; Hirata, 1974 y Watanabe et al., 1978.
Estas especies aportan un alto contenido nutricional para peces, crustáceos y moluscos, además de ofrecer facilidades de manejo en sistemas de cultivo tanto en laboratorio como en producción a gran escala con fines comerciales.
1. Consideraciones generales de los cultivos de microalgas
Muchos factores contribuyen para el desarrollo óptimo de los cultivos de microalgas, algunos de éstos afectan las características del crecimiento.
Los recipientes de cultivo más comúnmente usados son de materiales no tóxicos como las cajas de Petri, matraces Erlenmeyer, matraces Ferenback, carboys o garrafas, etc., adecuados para cultivos de laboratorio. Para cultivos a gran escala los recipientes de plástico, madera y concreto son los más recomendables, incluyendo los estanques rústicos en áreas rurales son los sistemas más económicos.
En cultivos masivos la aereación es un factor muy importante para la homogeneización de los nutrientes y para evitar la sedimentación de las microalgas. Las diatomeas suelen acumularse en lugares donde el agua no se mezcla, esto también depende de la forma del recipiente de cultivo que cuando no es adecuado retarda el crecimiento.
Otro factor importante es la penetración de la luz en el cultivo; en los cultivos masivos la profundidad es tan grande que la intensidad de la luz insidente no es suficiente para la fotosíntesis, hasta el fondo del tanque. En los cultivos masivos a la intemperie la penetración de la luz es más efectiva, pero se debe reducir la intensidad de la luz fuerte, cubriendo estos estanques con una malla. En cultivos a gran escala es recomendable la inyección de CO₂ (0.5%) para contribuir al proceso fotosintético.
Estas especies se han utilizado en acuicultura marina dado su valor nutritivo y digestibilidad, además de su capacidad para crecer en cultivos masivos. La duración del ciclo celular como los requerimientos de temperatura son susceptibles de variación mediante selección de variedades.
Tabla 7. Características de algunas de las especies de algas unicelulares utilizadas en Acuicultura (Coll-Morales J., 1983)

Tabla 8. Requerimientos principales de los cultivos de microalgas

En esta tabla se exponen los requerimientos principales de los cultivos de microalgas y sus valores aproximados. En cada caso habrá que estudiar los requerimientos particulares de la especie y de la variedad que se vaya a cultivar en las condiciones concretas de cultivo que se van a utilizar, por lo que estos datos son sólo orientación (Kinne, 1979).
El fotoperíodo es un factor que regula la división celular en diatomeas. La reproducción asexual (división) ocurre durante el período de luz y éste es acelerado bajo iluminación continua. En contraste, las especies formadoras de auxosporas (esporas sexuales), dan lugar a células del mismo tamaño y esto ocurre en el período de obscuridad. Por lo tanto, el período de iluminación puede ajustarse de acuerdo a los objetivos del cultivo: el fotoperiodo continuo (horas de iluminación prolongada) produce crecimientos rápidos, un fotoperíodo con horas de luz y obscuridad semejante al fotoperíodo solar mantiene un crecimiento normal y saludable.
En la Tabla 7 se muestran las características de algunas de las especies de microalgas unicelulares utilizadas en Acuicultura para la nutrición de moluscos y crustáceos.
Además del control de los parámetros antes mencionados es necesario considerar que para el establecimiento de un sistema de producción de alimento vivo es importante el dominio de las técnicas de aislamiento, purificación y mantenimiento de cepas, así como el conocimiento de la fisiología, ciclo de vida, bioquímica, etc. de las especies para determinar su factibilidad de cultivo y sobre todo su contenido nutricional para poder llevarse a niveles masivos de producción para fines Acuaculturales. La Tabla 8 muestra algunos de los principales requerimientos de los cultivos de microalgas.
2. Medios de cultivo
Se han desarrollado diferentes medios para el cultivo de microalgas que van desde las fórmulas para enriquecer el agua de mar natural, hasta el uso de medios artificiales que permitan resultados constantes en contraste con los resultados tan variables que brinda el uso del agua de mar natural que entre otros factores depende del lugar donde se colecta ésta, y el tiempo de almacenamiento de la misma.
Los medios artificiales se usan principalmente para fines experimentales, ya que como se ha mencionado, brinda resultados constantes, aunque existen algunas especies que no crecen en medios artificiales por factores desconocidos que afectan su crecimiento. Las principales fórmulas utilizadas van desde el agua de Miguel, que data de 1910, desarrollada por Allen-Nelson; el medio de EndSchereiber de 1934, hasta fórmulas específicas para familias como la fórmula del Laboratorio Haskins de Nueva York para diatomeas, Provasoli et al., 1975; Matthiesen & Thorner, 1966; McIachlan, 1973; Guillard F., 1973; Droop, 1975, 1979; Schoene, 1982, etc. Las principales formulaciones de los medios de cultivo, tanto de mantenimiento de cepas como de producción masiva (minerales, enriquecidos y orgánicos), se describen desde la Tabla 9 hasta la Tabla 16.
El fitoplancton se desarrolla y multiplica en relación de las condiciones fisicoquímicas del medio.
En términos generales son los macronutrientes o factores limitantes del crecimiento el carbono, Nitrógeno, Fósforo, Silicio, Magnesio, Potasio y Calcio, que se requieren en cantidades relativamente grandes, mientras que los llamados micronutrientes (Fierro, Manganeso, Cobre, Zinc, Sodio, Molibdeno, Cloro y Cobalto) se necesitan en menores cantidades.
Existen otros medios que incluyen en su composición sustancias orgánicas (vitaminas, aminoácidos) necesarios para aquellas especies de microalgas Auxótrofas, es decir que no sintetizan por medio de la fotosíntesis este tipo de compuestos y resultan factores que pueden limitar su crecimiento; tal es el caso de Platimonas, Chrysophytas y algunas Bacillariophyceas.
Tabla 9. Medio Chu 10 (modificado por Gerloff) (0. Umebayashi, 1975)

Tabla 10. Medio enriquecido

Tabla 11. Medio de yashima (sisffaa, 1964a) (Para cultivo masivo de cloroficeas marinas)

Tabla 12. Yanase & imai (1968) para monochrysis lutheri, platymonas sp., Nitzschia closterium, Chaetoceros calcitrans

* Mezcla de metales 100 ml, contenido: Na 2 EDTA, 100 mg; Fe, 1 mg; Zn, 0.5 mg; Mn, 4 mg; Co, 0.01 mg; Cu, 0.004 mg; B, 20 mg.
† Mezcla de vitaminas 50 ml, contenido: B 12 , 10 μg; biotina, 50 μg; B 1 , 5 mg
Tabla 13. Medio de Guillard & Rhyter (PARSONS & Strickland, 1961)

Tabla 14. Medio de Guillar “F/2” (J. Stein, 1979)

Tabla 15. Medio de Cultivo (Agua Dulce) (Guillard, In: Stein, 1979)

Tabla 16. Medio Met 44 (Schone & Schone, 1982) (Para microalgas marinas de la Familia Bacilarioficea)

Nota: La solución de stock de Fierro y Silicato debe de acidificarse un poco con una gota de Ácido Sulfúrico concentrado, y la solución de EDTA debe acidificarse con Ácido Clorhídrico.El EDTA puede ser adicionado antes que el Fierro.
Para la producción de microalgas a nivel comercial se usa el agua de mar enriquecida con fertilizantes agrícolas (Urea, Fosfato triple, Nitrato de Amonio, etc.)
(Chu, 1942, y Tamiya, 1957; SISFFAA, 1964a) y tradicionalmente la fertilización de estanques con abonos orgánicos en cultivos de especies herbívoras como las carpas.
3. Técnicas de aislamiento y purificación
Muchos métodos se han desarrollado para obtener cultivos monoespecíficos (de una sola especie) y axénicos (libres de contaminantes). A continuación se brinda una breve descripción de algunos de los principales métodos que se utilizan para aislar y purificar microalgas (O. Umebayashi, 1975) (Fig. 1).
1) Aislamiento
Pipeteo capilar: Se utiliza para separar microalgas mayores de 10μ, mediante una pipeta construida con un tubo capilar. A través del microscopio óptico se “pesca” las células y se separan en pequeñas gotas de nutrientes colocados alrededor de una caja de Petri o en portaobjetos escavados.
Rayado de Placas de Agar: Se transfieren pequeñas gotas de plancton con una asa de siembra, extendiendo por estrías (rompiendo un poco el agar). Este agar se prepara con una solución nutritiva para microalgas y con una relación de 1–1.5% w/v de agar disuelto en el medio nutritivo, se incuba la placa bajo iluminación a 18–20°. De este primer crecimiento se transfiere a tubos con agar inclinado sembrando por estrías o bien, se transfiere a medios líquidos en subcultivos sucesivos para su purificación, de tal manera que en cada dilución se reduzca el número de organismos en una gota, es recomendable combinar la técnica de diluciones con la de transferencia en placa de agar o tubo inclinado para obtener cultivos clonales (de una sola colonia o célula) y poder establecer el cultivo monoespecífico. Después de 10 días, pequeñas colonias aparecen sobre la superficie del agar, que se pueden transferir mediante el Método de Hocking o de la micropipeta a medios líquidos.
2) Purificación
Como ya se mencionó al describir las técnicas de aislamiento, estas mismas nos permiten purificar el cultivo a través de las resiembras clonales sucesivas, pero además es recomendable entre otros métodos el uso de antibióticos para eliminar otros microorganismos, generalmente de tipo bacteriano, que estén contaminando el cultivo de microalgas de nuestro interés. En el inciso 5 de este mismo capítulo correspondiente a Métodos de Esterilización se amplían las alternativas.
3) Control Bacteriológico
Para determinar el desarrollo bacteriológico realizamos lo siguiente:

Fig. 1a) Método de filtración a través de una columna empacada con algodón
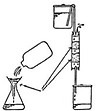
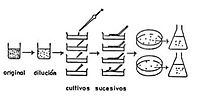
Fig. 1c) Método de aislamiento y purificación de microalgas en placa de agar.
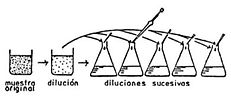
Fig. 1b) Aislamiento y purificación de microalgas por el método de diluciones algodón.

Fig. 1d) Aislamiento mediante micropipeta y el uso de microscopio.
Una vez preparado colocar en Cajas de Petri, una capa no muy gruesa. Someter a esterilización a 15 libras. de presión y 125°C. Con una asa de Platino picar el agar con la muestra que se desea analizar y colocar a la luz y observando si hay crecimiento bacteriano.
Una vez preparado colocar en Cajas de Petri, una capa no muy gruesa. Someter a esterilización a 15 lbs. de presión y 125°C. Con una asa de Platino picar
el agar con la muestra que se desea analizar y colocar a la luz y observando si hay crecimiento bacteriano.
2. Si el cultivo presenta bacterias es aconsejable someter a la acción combinada de diferentes tipos de penicilina, por ejemplo:

Filtrar en equipo estéril, adicionar volúmenes de 3.0, 2.0, 1.0, 0.5 y 0.25 que dan concentraciones de:
Ejemplo:

4. Determinación de la densidad de población de las microalgas
Cuando el plancton es utilizado para alimentar larvas u organismos filtroalimentadores como los moluscos, el suministro constante y la concentración de estos alimentos son factores que determinan la supervivencia y desarrollo de los organismos en cultivo. A continuación se hace una descripción breve de los métodos que se utilizan para determinar el número de células presentes en una muestra de plancton.
1) Hemocitómetro o Cámara de Neubaver (Fig. 2)
Mediante una pipeta Pasteur se toma una muestra de plancton y se desliza en la cámara que previamente tiene adherido el cubreobjetos, se deja pasar 5~10 minutos para que la muestra se estabilice; se procede a contar mediante un contador de mano, en algunos casos es necesario diluir la muestra cuando la densidad es alta y también fijada cuando el plancton es móvil, siguiendo los siguientes pasos:
-
Se toma un milímetro de la muestra.
-
Se añade un mililitro de agua de mar filtrada ya preparada con formaldehído todo al 4%.
-
Se deja reposar por tres minutos.
-
La muestra se homogeniza con una Pipeta Pasteur.
-
Se cuentan las células de cada una de las cámaras.
Una vez que se tiene el promedio de células de las cámaras, el cálculo total de células por mililitro se lleva a cabo de la siguiente manera:

Fig. 2a) Conteo celular en homatocímetro.

Fig. 2b) Cuadrantes de la cámara de conteo.

2) Densidad Óptica
Mediante un espectrofotómetro se determina la concentración celular de la muestra por densidad óptica (calibrando con anterioridad el aparato, siguiendo las instrucciones del manual correspondiente),
se determina la transmitancia (Nm), que se extrapola con la recta patrón antes determinada que corresponda a la especie problema (se construye graficando transmitancia vs. núm. de células/ml). Así en la intersección de la recta conociendo la concentración (Nm) se puede calcular la cantidad de microalgas de la muestra problema.
Por otro lado, conociendo la ecuación de la recta de cada gráfica, según la especie, se determina directamente la concentración de células de la muestra sustituyendo el valor de la transmitancia en esta ecuación.
3) Volumen Celular
Por centrifugación, se obtiene “un paquete o pastilla celular” que desechando el sobrenadante, puede ser pesado y determinado en unidades de peso W/v, la cantidad de células o biomasa de la muestra problema en peso húmedo o peso seco.
4) Composición Química
En algunos estudios se puede determinar la concentración de clorofila A,B y otros pigmentos presentes en la muestra. Debe considerarse que la composición química del fitoplancton varía de acuerdo al tipo de cultivo usado, medio nutritivo y otros factores, por lo que es necesario realizar el estudio de la composición química (análisis proximal) de la especie de estudio en relación al tipo de cultivo desarrollado.
5. Métodos de esterilización
Existen diferentes métodos para lograr las mejores condiciones de desarrollo de las microalgas, libres de microorganismos contaminantes, tanto del aire como del agua. A continuación se describen brevemente los métodos más comunes de esterilización que varían en los resultados de eficiencia, costos y tiempo invertido.
1) Esterilización Química
Uno de los métodos más comunes dentro de este tipo de esterilización, es el uso del Hipoclorito de Sodio (Cloro comercial), resulta ser de bajo costo y brinda buenos resultados para desinfectar recipientes de cultivo, material de cristalería y además podemos esterilizar el agua de mar con la que preparamos el medio de cultivo, utilizando 50 mg de Tiosulfato de Sodio por cada 1 ml de Hipoclorito de Sodio usado; es decir, se utiliza 416 ml de Cloro comercial (6%) y se afora ésta a 1,000 ml (mantenga esta solución en la oscuridad); de esta solución agregue 0.25 ml por litro de agua, deje reposar por 12 h y añada 0.1 ml de una solución de Tiosulfato (ésta se prepara con 248.1 gr de Tiosulfato, aforado a 1,000 ml), y posteriormente introduzca aereación al recipiente de cultivo (carboy o garrafon) y déjelo así por una hora. Una vez esterilizado de esta manera, agregue los nutrientes y vitaminas previamente esterilizados.
Esterilización con Formol
Se recomienda su uso en los casos en que exista una contaminación en las instalaciones o laboratorio por hongos y otros microorganismos. Se utiliza una concentración de 0.1% al 10% (no se utiliza para material de cristalería o recipiente de cultivo).
Solución de Alcohol Etílico al 70%
Se recomienda para material de cristal (pipeta, cajas de Petri, tubos de ensayo, etc.). Se pueden utilizar otro tipo de alcoholes (Isopropanol, o Propanol e incluso el Fenol, pero éste último es muy tóxico).
2) Esterilización Física
Esterilización por Calor Húmedo
Utilizando difusores de vapor a una temperatura de 100~110°C, se recomienda para estanques y tuberías de agua y de aire, destruye microorganismos vivos e incluso destruye esporas. Se recomienda utilizarlo por tres días consecutivos. Este método recibe el nombre de Tindarización.
Autoclave
Se recomienda para la esterilización de medios de cultivo, vitaminas, material de cristal. Tiene la desventaja del tiempo que se invierte y el volumen que se puede esterilizar.
Filtración
Se utiliza para separar partículas orgánicas o microorganismos en los medios de cultivo o instalaciones del sistema de aceleración.
Existen diferentes tipos de los que podemos mencionar: filtros milipore (membranas, vidrio, celulosa, etc), filtros de fibra (algodón, vidrio, materiales sintéticos), filtros de tierra de diatomeas, geles de acrilamida (esferas de diferentes tamaños en micras), empaques de algodón y carbón activado, y finalmente existen unidades comerciales de esterilización con cartuchos sintéticos (0.45μ, 3μ, 5μ, 20μ) etc.
Esterilización por U.V.
Los efectos de la irradiación ultravioleta son bacteriostáticos y fungistáticos en longitudes de onda menores de 500 NM (Jerlov, 1970).
Se recomienda para estos fines las longitudes de onda de 240 a 280 NM Las máximas eficiencias se obtienen cerca de los 254 NM (Kinne, 1976). Los rayos ultravioleta desinfectan el agua. El dato más importante y preciso sobre un tratamiento con rayos U.V. es la dosis de U.V. (normalmente expresada en μW seg/cm²) requerida para matar a un determinado porcentaje de la población de organismos contaminantes. Un antecedente importante son las experiencias reportadas sobre la utilización de unidades de U.V. para desinfectar criaderos de peces y ostiones, cultivos de microalgas, agua de mar almacenada (Fig. 3 y Tabla 4) (Kinne, 1976; Wheaton, 1977; Aguirre, 1981; Torrentera & Franco, 1988).
3) Criterios de Eficiencia para la Selección y Utilización de los Métodos de Esterilización Mencionados
a. Método Indirecto: Se analiza el estado de salud y las tasas de supervivencia de los organismos en cultivo.
b. Método Directo: Se calcula el porcentaje de reducción de microorganismos, analizando el número de éstos presentes en muestras no tratadas y el número de los mismos presentes en muestras obtenidas después de la aplicación del tratamiento de esterilización seleccionado. Esto se puede determinar mediante análisis bacteriológicos (método standard en placa de agar); cuantificando el número de colonias presentes en la caja después de haber inoculado 1 ml de cada muestra por un período de revisión de 24 h, 48 h, 96 h. Para muestras de agua marina se recomienda el Medio de Zobell que selecciona el crecimiento de bacterias marinas; para Coliformes totales se recomienda el Medio McConkey, entre otros. En las Figs. 3 y 4 se muestran resultados de diferentes métodos de esterilización.
6. Equipo e instalaciones
a. Sala o Laboratorio de Cultivo: Se recomienda para fines de mantenimiento de cepas, transferencias sucesivas de cultivos, crecimiento de cultivos en pequeños y medianos volúmenes. Generalmente para fines de investigación las siguientes características:
-
Laboratorio con temperatura controlada 18–20°C.
-
Paredes y pisos de azulejo en color blanco.
-
Instalaciones para el cepario y cultivo intermedios con lámparas de luz blanca fría fluorescente (20W–37W).
-
Instalaciones tipo invernadero (ventanas de cristal o plástico con temperatura controlada).
b. Cuarto de Siembra: Puede instalarse dentro del mismo laboratorio una cabina con campana de flujo laminar o bien una simple mesa de laboratorio con instalación de gas para dos mecheros para la inoculación en condiciones asépticas.
c. Sala de Producción: Para volúmenes de 200 l o más, se requieren recipientes de materiales plásticos no tóxicos y de preferencia transparentes para el desarrollo a nivel masivo de las diferentes especies del plancton. En este tipo de instalación es recomendable el uso de la luz solar, pues el uso de la luz artificial es de muy alto costo y se requiere, además, de equipo para mantener la temperatura a 18–20°C. En zonas de clima templado para cultivos masivos se pueden desarrollar éstos a la intemperie, cubriendo los recipientes en caso de lluvia. En la Figura 5 se muestra un ejemplo de instalaciones para cultivo masivo, utilizando la luz solar.
7. Tipos de cultivo
1. Cultivo Estático

Figura 3a: Promedio de las Bocterlas viables formadoras de Colonia (C.F.U.) por milímetro después de diversos tratamientos. (Barroso, 1987).

Figura. 3B: Porcentajes do Reducción (C.F.U.) obtenidos con diversos tratamientos. (Barroso, 1987).
Desarrollo del cultivo hasta la fase de crecimiento exponencial y la utilización del volumen total del mismo. Generalmente el uso de estos cultivos es para fines de bioensayo o bien para transferencia a volúmenes mayores (ver la Figura 6, que ilustra la secuencia del cultivo).
2. Cultivo Continuo
De acuerdo a Kubitschek (1970), un cultivo continuo es un sistema de flujo en el cual las células individuales están suspendidas en un volumen constante en un estado de equilibrio dinámico, establecido por una remoción de cultivo y adición de medio nutritivo por unidad de tiempo con tendencia al infinito.
Se habla de una diferencia entre un cultivo semicontinuo y un cultivo continuo. Al parecer esto es incorrecto, ya que la diferencia estriba en el número de períodos de remoción del cultivo y adición del medio nutritivo y en los sistemas continuos. Este período de remoción y adición es generalmente automático en aparatos llamados turbidostatos y Quimiostatos.
Cuando se requiere de grandes cantidades de células a intervalos frecuentes para alimentar especies en cultivo (peces, crustáceos, moluscos), los cultivos semicontinuos o continuos proveen un gran número con mayor consistencia en forma uniforme y constante. En estos cultivos es importante determinar la concentración óptima de los nutrientes por unidad de tiempo en relación a la tasa de dilución o cosecha del cultivo. Cuando se establece el estadio de equilibrio del sistema, la producción es máxima. En las Figuras 7 y 8 se muestran dos ejemplos de cultivo semicontinuo.
3. Cultivo Masivo
Tabla 17. Resultados reportados sobre el uso de esterilización U.V. en Acuicultura (Torrentera & Franco, 1988)

Se considera cultivo masivo a aquellos que se utilizan como alimento vivo de peces, crustáceos y moluscos y cuya producción es a gran escala en tanques u otros recipientes de volumen no controlado.
Existen muchas alternativas para la producción de microalgas en cultivo masivo, desde la utilización de tanques de plástico, madera, concreto hasta los estanques rústicos, así como la utilización de fertilizantes minerales de tipo agrícola hasta una gran variedad de excretas de ganado como fuentes de nutrientes.

Fig. 4a) Esquema del invernadero de Wachapreague (USA). Cultivo masivo con temperatura controlada en invernadero con ventilador.

Fig. 4b) Cultivo masivo a la intemperie de algas unicelulares en tanques de fibra de vidrio (la temperatura es controlada por enfriadores sumergibles. La Joya, San Diego, U.S.A).
En relación a la utilización de luz artificial o natural, ésta dependerá del tipo de infraestructura con que se cuente.
El control de la temperatura será necesario en relación del tipo de microalga en cultivo y de la región climática en donde se establezca el mismo. En la Tabla 17 se muestran algunas alternativas de producción en cultivo masivo de microalgas.

Fig. 5) Secuencia de cultivo en sistema estático. Cuando se ha alcanzado una densidad óptima de células, se utiliza todo el cultivo como inóculo de la siguiente fase.

Fig. 6) Cultivo semicontinuo (R. Ukeles, en Stein, 1979). Esquematización diagramética de un cultivo semicontinuo (1), cilindro de CO2, (2) botella colectora de cultivo, (3) cámara de llenado escéptico, (4) flujómetro de gas, (5) filtro de aire, (6) regulador de presión, (7) compresor de aire, (8) salida de gas, (9) campana de llenado ascéptico sobre el inoculador, (10) sifón de cosecha, (11) válvula de aguja para regular la presión del gas, (12) entrada de gas con filtros de algodón y difusores de aire, (13) regulador de voltaje, (14) unidad de crecimiento, (15) matraz Fernbach con inóculo.

Fig. 7) Cultivo semicontinuo (Cáceres, 1979; Aguirre, 1981). Sistema de cultivo semicontinuo de Tetraselmis suecica usando medio de cultivo esterilizado con autoclave. A) Reserva de medio de cultivo (20 1); B) Sifón para el medio de cultivo; C) Escape de aire; D) Recipiente de cultivo (bolsa de plástico); E) Dosificador de aire; F) Filtro de aire; G) Sifón de cosecha; H) Recipiente de cosecha.
8. Modelos de producción
Alrededor de 1960 se inició la modelación de los cultivos continuos con bacterias (Fencl, 1966), basados en la teoría básica desarrollada por Monod (1950). En relación a estas teorías matemáticas se han desarrollado numerosos trabajos con microalgas bajo el sistema de cultivo continuo, con diferentes fines de estudios: bioquímicos, fisiológicos, nutricionales, etc., como es el explorar los mecanismos de limitación de nutrientes (Droop, 1966; Caperon, 1968).
Ahora se llevan a cabo numerosos trabajos con microalgas en sistemas de cultivo continuo con el objeto de determinar la mayor producción posible (Droop, 1975; Ukeles, 1973; Canzonier & Brunetti, 1975; Cáceres, 1979; Aguirre, 1981; Pares & Leyva, 1982; Torrentera, 1983). Estos trabajos también han contribuido en la implementación de sistemas de cultivo, algunos muy complejos usados para estudiar la fisiología y bioquímica de las microalgas en condiciones axénicas, otros menos sofisticados para producir las microalgas y así utilizarlas como alimento de invertebrados marinos y larvas de peces.
Algunos de estos modelos se construyen con los datos de densidad (No. de cél/ml) u otros tipos de medición, como la densidad óptica (Nm), en relación a las tasas de dilución (volumen/día).
En el caso del Modelo de Monod (1950), la relación entre la densidad y la dilución describe una curva exponencial negativa, mientras que el Modelo de Droop (1966) asume esta relación como lineal. En ambos casos la producción se describe como una parábola simétrica (Droop, 1966) o asimétrica (Monod, 1950).
Tabla 18. Alternativas de producción a gran escala de microalgas para alimentación en acuicultura

Conwy (Inglaterra): 5×10⁶ Ostrea de 0.3 cm/año Wachapreague (Virginia, USA): 200×10⁶ almejas de 0.5 cm/año
Ribadeo (Lugo, España): 3×10⁶ Ostrea de 1 cm/año
Horn-Point (Maryland, USA): 15×10⁶ Crassostrea de 1 cm/año
Lewes (Delaware USA): 5×10³Crassostrea de 6 cm/año
Woods-Hole (Massachusetts, USA): 2×10³ Crassostrea de 6 cm/año
* Células (Tetraselmis equivalentes)
En las Figuras 9, 10 y 11 se muestran tres ejemplos de modelos de producción de tipo parabólico en donde el punto de inflexión de la curva describe la producción máxima sostenible en la tasa de dilución óptima para tres diferentes especies de microalgas en sistemas de cultivo semicontinuo.

Fig. 8a) Relación entre la densidad y la dilución para un cultivo semicontinuo de Tetraselmis suecica, donde se muestran las medias de los valores obtenidos con los límites de confianza al 95% de una distribución normal. La relación se obtiene de acuerdo al Modelo de Monod (1950). Aguirre, 1981.

Fig. 8b) Relación entre la producción y la dilución en el cultivo semicontinuo de Tetraselmis suecica. La dilución óptima se encuentra en el punto de inflexión de la curva.
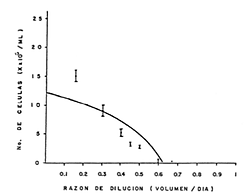
Fig. 9a) Relación entre la densidad y la dilución para un cultivo semicontinuo de Isochrysis galbana, donde se muestran las medias de los valores obtenidos con los límites de confianza al 95% de una distribución normal. La relación se obtiene de acuerdo al Modelo de Monod (1950) (Pares & Leyva, 1987).

Fig. 9b) Relación entre la producción y la dilución en el cultivo semicontinuo de Isochrysis galbena. La dilución óptima se encuentra en el punto de inflexión de la curva (Pares & Leyva, 1982).

Fig. 10a) Modelo de Droop (1966) que asume la distribución de los datos en forma lineal de la densidad (X) de Chlorella saccharophila en función de la tasa de dilución (D) (Torrentera, 1983).

Fig. 10b) Modelo de producción de Droop, para Chlorella saccharophila basado en los datos de la regresión lineal (Torrentera, 1983).