
19ª Parte: Nutrición de proteínas y aminoácidos en especies de peces marinos
Resumen
La acuicultura intensiva de especies de peces marinos se ha expandido mucho durante las últimas décadas y tiene potencial para seguir aumentando. Se requerirá un suministro mayor y constante de alimentos acuícolas de alta calidad para sostener esta producción y garantizar la producción de proteínas de alto valor biológico para los humanos. La proteína es el nutriente dietético más abundante y costoso en los alimentos acuícolas y la harina de pescado sigue siendo la principal fuente de proteína dietética en los alimentos acuícolas marinos. Dada la importancia zootécnica, ambiental y económica de una dieta bien balanceada, el ajuste fino de la composición de proteínas y aminoácidos de la dieta para cumplir con los requisitos de los peces es, por lo tanto, de suma importancia.

Esto es de particular importancia cuando se considera la sustitución dietética de la harina de pescado por fuentes de proteínas más sostenibles y renovables, como los alimentos vegetales, que tienen desequilibrios de aminoácidos, factores antinutricionales, menor contenido de proteínas y digestibilidad, y carecen o contienen concentraciones muy bajas. de algunos micronutrientes particulares, como la taurina. Al mismo tiempo, en los peces, la utilización de aminoácidos con fines energéticos se considera alta, por lo que la optimización de la acumulación de aminoácidos/proteínas tiene una gran importancia e implicaciones prácticas. Además de las propiedades nutricionales de los aminoácidos, la evidencia emergente muestra que algunos de ellos tienen propiedades funcionales, regulando vías metabólicas clave cruciales para el mantenimiento, el crecimiento y las respuestas inmunitarias, siendo de gran interés en la producción de peces. Se enfatizará la importancia de obtener más conocimientos sobre los requisitos, el metabolismo y la utilización de aminoácidos como ingredientes funcionales en las especies de peces de acuicultura.
Palabras llave: Aminoácidos; Acuicultura; Pescado marino; Nutrición; Proteína; Requisito
Introducción
La acuicultura intensiva es un sistema de producción basado en alimentos y, por lo tanto, es necesario mejorar la especificación de la dieta para reducir los costos y aumentar la productividad al tiempo que se garantiza la producción de proteínas de alto valor biológico para los seres humanos. Para abordar esto, se requiere información crítica sobre el requerimiento de proteínas de las especies objetivo en diferentes fases del ciclo de vida.
De hecho, la proteína es uno de los componentes dietéticos más costosos y un factor importante que influye en el rendimiento del crecimiento de los peces, el costo del alimento y la contaminación por nitrógeno y, por lo tanto, en la productividad y la sostenibilidad ambiental de los peces de cultivo. Un suministro deficiente de proteína en la dieta conduce a una disminución del crecimiento y, por lo tanto, a una pérdida de producción económica, pero si se proporciona en exceso de los requisitos, la proteína se cataboliza y se utiliza con fines energéticos, lo que aumenta la carga de nitrógeno en el medio ambiente. Por lo tanto, el conocimiento de los requisitos de proteínas y aminoácidos esenciales (EAA) de la especie y el perfil dietético óptimo de EAA es de particular importancia para la formulación de dietas rentables destinadas a maximizar el crecimiento y la retención de proteínas mientras se minimiza la excreción de nitrógeno. Estos datos también son un requisito previo para la evaluación correcta de fuentes de proteínas alternativas a la harina de pescado con el fin de reducir la dependencia real de los alimentos acuícolas de este producto. Aparte del bajo contenido de proteínas digeribles de la mayoría de los alimentos vegetales, los alimentos de proteínas vegetales también tienen deficiencias en ciertos aminoácidos esenciales como lisina, metionina y arginina y aminoácidos funcionales como taurina e hidroxiprolina (Aksnes et al., 2008; Zhang et al. 2013). ; Salze y Davis, 2015). Por lo tanto, pueden ocurrir deficiencias/desequilibrios de AA en la dieta cuando se utilizan alimentos vegetales como los principales ingredientes de la dieta, lo que reduce el crecimiento y la utilización del alimento (Gatlin et al. 2007). Es probable que la producción de dietas sin harina de pescado, capaces de soportar las tasas de crecimiento necesarias para la producción económica de peces de cultivo, requiera la adopción de enfoques de formulación más modernos, teniendo en cuenta la disponibilidad de nutrientes, especialmente con respecto a EAA, y combinando diferentes alimentos para plantas y suplementos de EAA para cumplir con el EAA requerido para la especie (Nunes et al. 2014).
Requerimientos de proteínas
Las especies de peces requieren altos niveles de proteína en la dieta, 2-4 veces más altos que los de los animales de granja, aunque en términos absolutos (proteína por unidad de aumento de peso) los requisitos no son más altos que los de los animales de granja (Cuadro 1; Bowen, 1987). El mayor contenido de proteínas de las dietas de pescado podría atribuirse incorrectamente a los hábitos de alimentación carnívoros de los peces; sin embargo, se debe principalmente a las diferencias en los requisitos de energía entre los peces y los animales de granja.
Los peces son animales heterotérmicos y, por lo tanto, no gastan mucha energía en su mantenimiento. Los requerimientos de energía para el mantenimiento son alrededor de 10 a 20 veces menores en los peces que en los animales de granja, los cuales son animales homeotérmicos y, por lo tanto, gastan grandes cantidades de energía para mantener la temperatura corporal (Cho y Kaushik, 1990). Además, los peces también tienen bajos requisitos de proteínas de mantenimiento, que representan solo del 11 al 35% de las necesidades totales de proteínas (Cho y Kaushik, 1990; McGoogan y Gatlin, 1998; Lupatsch et al. 2001; 2003; Dias et al. 2003; Peres y Oliva-Teles, 2005; Ozório et al. 2009). Por lo tanto, el contenido de proteínas de la dieta en relación con la densidad energética de la dieta es mayor en los peces que en los animales de granja, lo que explica sus necesidades aparentemente altas de proteínas en la dieta.
Tabla 1. Rendimiento del crecimiento, dieta y eficiencia de utilización de proteínas de peces y animales terrestres¹.

Los requisitos de proteína dietética de las especies de peces marinos se han investigado principalmente sobre la base de estudios convencionales de respuesta a la dosis, que arrojan la proteína mínima requerida para lograr el crecimiento máximo. Los estudios indican que el requerimiento de proteína dietética para el crecimiento máximo de los peces marinos oscila entre el 27% y el 55% (Tabla 2). Las necesidades dietéticas de proteínas suelen ser menores para las especies omnívoras, como la dorada y la dorada, que para las especies carnívoras. Estas diferencias en los requerimientos de proteínas en la dieta pueden estar relacionadas con diferencias entre especies en cuanto a hábitos de alimentación o en el potencial de crecimiento (Oliva-Teles et al. 2011).
En comparación con los salmónidos, la mayoría de las especies de peces marinos carnívoros aparentemente tienen mayores necesidades de proteínas y utilizan las proteínas de la dieta de forma menos eficiente.De hecho, la retención de proteínas como porcentaje de la ingesta oscila entre el 30 y el 40 % para los salmónidos y entre el 25 y el 35 % en los peces carnívoros marinos (Tibaldi y Kaushik, 2005; Lall y Anderson, 2005). Esta diferencia en la eficiencia de las proteínas puede tener una base nutricional o puede deberse a una formulación inadecuada de la dieta. Siendo este el caso, es de esperar que un mejor conocimiento de los requisitos nutricionales de los peces marinos pueda mejorar la eficiencia de utilización de proteínas y, en consecuencia, permitir una reevaluación de los requisitos de proteínas en la dieta (Tibaldi & Kaushik, 2005).
La proteína dietética se puede usar para fines plásticos o energéticos, dependiendo de la proporción general de proteína dietética a energía. Además, los peces están bien adaptados para metabolizar las proteínas y las utilizan preferentemente como fuente de energía antes que los lípidos o los carbohidratos (Walton y Cowey, 1982). Por lo tanto, la optimización de la proporción de proteína dietética digestible a energía digestible (DP:DE) es de crucial importancia para mejorar la utilización de proteínas, ya que permitirá ahorrar proteínas con fines energéticos y utilizarlas preferentemente para la síntesis de proteínas (Cho y Kaushik, 1990). De hecho, la relación DP:DE es una forma más racional de expresar los requerimientos de proteína que la proteína cruda dietética sola (NRC, 2011). Para las especies de peces marinos, la recomendación de una relación dietética óptima DP:DE oscila entre 20 y 32 g DP/MJ DE, según la especie (NRC, 2011). Por otro lado, para los salmónidos, la relación dietaria óptima DP:DE es de 17-18 g DP/MJ DE (Hillestad y Johnsen, 1994; Hillestad et al. 1998).
Esta enorme diferencia entre los grupos de peces puede estar relacionada con la capacidad de los salmónidos de usar una dieta más rica en lípidos que los peces marinos (Peres & Oliva-Teles, 1999a; NRC, 2011).
Una optimización de la relación DP:DE, a través de la reducción del nivel de proteína en la dieta con o sin el aumento concomitante del nivel de energía, reduce la utilización de proteína para cumplir con los requisitos de energía, reduciendo la excreción de amoníaco y el impacto ambiental de la acuicultura (Cho, 2008; CNR, 2011). En la lubina, por ejemplo, la reducción del nivel de proteína en la dieta del 56 al 48 % condujo a una reducción significativa (alrededor del 26 %) de la contribución relativa del catabolismo proteico al gasto de energía y una reducción (alrededor del 28 %) de la excreción de amoníaco (Peres & Oliva-Teles, 2001). De manera similar, para la corvina negra, una reducción del 7,5 % del nivel de proteína en la dieta redujo la excreción de amoníaco en aproximadamente un 20 % (Li et al., 2016a) y para la corvina roja, una reducción de la proteína en la dieta del 45 al 35 % redujo la excreción de amoníaco en aproximadamente un 22 %. (Webb & Gatlin, 2003) y redujo la producción de amoníaco posprandial a las 6 horas en aproximadamente un 56% (Wu & Gatlin, 2014). Para la mayoría de las especies de peces, los lípidos han demostrado ser proveedores de energía más eficientes que los carbohidratos (Enes et al. 2010). Se ha demostrado que los lípidos de la dieta ahorran proteínas en la mayoría de las especies de peces (Cho, 2008). Sin embargo, la magnitud del efecto ahorrador de proteínas de la suplementación con lípidos parece depender del nivel de proteína en la dieta, siendo más pronunciado para niveles más bajos de proteína (Dias et al. 1998).
De hecho, las dietas alimentadas con lubinas que incluyen un nivel de proteína que cumple con los requisitos de proteína (Peres y Oliva-Teles, 1999b) no lograron una mejora en el crecimiento o la utilización de proteínas al aumentar el nivel de lípidos en la dieta del 12 al 24% (Peres y Oliva-Teles, 1999b). ). De manera similar, para otras especies de peces, también se ha informado que el aumento del nivel de lípidos de las dietas con un nivel adecuado de proteínas no tiene un efecto importante en la utilización de proteínas (McGoogan & Gatlin, 1999; Ozório et al. 2006; Velázquez et al. 2006). ; Bonaldo et al. 2010; Sevgili et al. 2014). En lenguado senegalés, también se observó que la temperatura puede afectar el grado de ahorro de proteínas por energía no proteica (Guerreiro et al. 2014).Algunas especies, como el lenguado senegalés, son aún menos tolerantes y los altos niveles de lípidos en la dieta afectan negativamente el crecimiento y la utilización de proteínas (Dias et al. 2004; Guerreiro et al. 2012). La principal preocupación de aumentar el nivel de lípidos en la dieta es el aumento de la deposición de lípidos en la canal, lo que puede afectar negativamente el valor nutricional, las propiedades organolépticas, el rendimiento de transformación y el tiempo de almacenamiento del pescado. En los peces, particularmente en los carnívoros, la utilización de carbohidratos en la dieta es limitada (Stone, 2003; Enes et al. 2009; 2011). Los altos niveles de carbohidratos en la dieta conducen a una hiperglucemia posprandial prolongada y a una utilización ineficiente de los carbohidratos (Enes et al. 2011). Puede ser necesario un tratamiento térmico para mejorar la utilización digestiva de los carbohidratos y las tecnologías modernas han permitido extender la incorporación dietética de carbohidratos en las dietas de algunas especies de peces, como la lubina y la dorada, hasta un 20-30% (Couto et al. 2008; Oliva-Teles et al. 2011) .
Tabla 2. Requerimiento de proteínas de varias especies de peces marinos


Requisitos de la AEA
Diez aminoácidos esenciales (EAA) deben ser proporcionados por los ingredientes de la dieta, ya que no pueden ser sintetizados por los peces (arginina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina). La cisteína se puede sintetizar a partir de la metionina y la tirosina a partir de la fenilalanina, considerándose aminoácidos semiesenciales. La deficiencia en solo uno de estos AA afectará la síntesis de proteínas y deprimirá el crecimiento de los peces (Wilson, 2002). Los requisitos cuantitativos de AA para las 10 EAA solo se determinaron para unas pocas especies de peces (NRC, 2011).
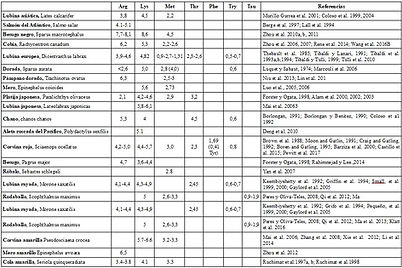
Para los peces marinos, los requisitos cuantitativos de algunos AAE se evaluaron mediante estudios de dosis-respuesta, basados en el crecimiento animal o las respuestas de retención de nitrógeno a niveles dietéticos crecientes del AAE en estudio (Tabla 3). Los datos disponibles sugieren algunas similitudes pero también una variación del requisito de EAA entre especies. Parte de esta variación entre especies puede deberse a diferencias en los enfoques metodológicos, lo que enfatiza la necesidad de métodos de estandarización (Dabrowski & Guderley, 2002).
Tabla 3. Requerimientos de aminoácidos esenciales (g/16g N) de algunas especies de peces marinos estimados por estudios de dosis-respuesta.
Se han planteado varias cuestiones metodológicas, entre ellas: el tipo y la composición de la dieta, que afectan la capacidad de los peces para alcanzar su máximo potencial de crecimiento; el criterio de respuesta utilizado para estimar los requerimientos (crecimiento, retención de nitrógeno, respuestas metabólicas) y diferencias en el diseño experimental, análisis estadístico y modelado de respuesta (Shearer, 2000; Bureau y Encarnação, 2006; Kaushik & Seiliez, 2010).
Se debe dar especial énfasis a la composición de las dietas experimentales (Nunes et al. 2014). En los estudios de dosis-respuesta, a menudo se utilizan dietas purificadas o semipurificadas, en las que los AA unidos a proteínas se reemplazan por AA cristalinos. En algunos estudios, se demostró que el uso de tales dietas es menos efectivo para promover el crecimiento de los peces que las dietas que contienen solo proteína intacta (Cowey, 1995; Zarate y Lovell, 1997). Esto puede ser un problema, ya que es importante que los peces alimentados con dietas semipurificadas se desempeñen tan bien como los peces alimentados con dietas prácticas.
Por lo tanto, para una evaluación imparcial del requerimiento de EAA es necesario confirmar que los animales utilizan efectivamente los AA cristalinos (Peres & Oliva-Teles, 2005). Los niveles máximos tolerables de AA cristalino que no perjudiquen el rendimiento del crecimiento o la eficiencia de utilización del alimento pueden depender de las especies de peces.
Por ejemplo, en rodaballo se logró un máximo del 19% de reemplazo de proteína por AA libre sin afectar el rendimiento del crecimiento (Peres & Oliva-Teles, 2005), pero se informó que niveles de inclusión más altos, alrededor del 30-55% de la proteína dietética, eran factibles para otras especies, como la dorada, la dorada, la lubina o el lenguado senegalés (Webb & Gatlin, 2003; Marcouli et al. 2005; Alam et al. 2005; Peres y Oliva-Teles, 2007; Perez-Jimenez et al. 2014) ).
El perfil dietético de EAA, la proporción de EAA a no-EAA y la composición de la fracción no-EAA de las dietas también son cuestiones importantes, ya que afectan el crecimiento y la utilización de proteínas (Mambrini y Kaushik, 1995; Kaushik y Seiliez, 2010). El perfil EAA de cuerpo entero suele utilizarse como el perfil EAA más apropiado para la proteína ideal, sin embargo, para especies marinas como la dorada, la dorada y la lubina, el perfil EAA de harina de pescado también proporciona resultados satisfactorios (Marcouli et al. 2005). , Alam et al., 2005; Peres & Oliva-Teles, 2007; Fig. 1). Esto no es inesperado, ya que la harina de pescado generalmente se considera la fuente de proteína más adecuada para los peces y el perfil de EAA de las especies de peces no es muy diferente.
Para garantizar los mejores rendimientos y la mejor utilización del alimento, se debe proporcionar una cantidad adecuada de no-EAA en las dietas, ya que los EAA no siempre se utilizan de manera eficiente como fuente de nitrógeno no específica para la síntesis de no-EAA. De hecho, las dietas con niveles bajos de no-EAA se usan de manera menos eficiente que las dietas con proporciones adecuadas de EAA a no-EAA en pollos, cerdos y peces (Mambrini y Kaushik, 1994; Schuhmacher et al. 1995; Abboudi et al. 2009) . Por ejemplo, se estimó que la proporción de EAA a no-EAA de la dieta más adecuada para la lubina era de 0,55-0,60 (Peres & Oliva-Teles, 2006; Fig. 1), que es similar a las proporciones establecidas para salmónidos y animales terrestres (Green et al. 2002; Gómez-Requeni et al. 2003). Otro aspecto importante cuando se usan dietas con AA ligado a proteínas y cristalino es asegurar que la absorción de AA cristalino esté sincronizada con la del AA ligado a proteína, para garantizar que todos los AA estén presentes en el cuerpo de AA simultáneamente (Fournier et al., 2002; Peres & Oliva-Teles, 2005, 2006, 2007). De lo contrario, puede ocurrir una disponibilidad desequilibrada de AA a nivel fisiológico y metabólico. Por lo tanto, puede ser necesario considerar la posibilidad de recubrir el AA cristalino con agar o gelatina para retrasar su absorción. Además, recubrir el AA cristalino también reduce la lixiviación del AA cristalino durante la exposición de la dieta al agua y evita problemas relacionados con la dieta ácida en peces sin estómago.

Fig. 1. Comparación del rendimiento de la lubina alimentada con una dieta de control (que contiene solo proteína intacta) y dietas de prueba (que contienen AA libre que reemplaza el 60 % del nitrógeno de la proteína intacta de la dieta de control) con diferentes perfiles de EAA y relación EAA/no-EAA. WBC: perfil EAA de cuerpo entero; REQ: perfil ideal de proteína EAA; FM: harina de pescado perfil EAA) (Datos de Peres & Oliva-Teles, 2006; 2007).
A pesar de la variabilidad de los requisitos de EAA entre especies, también es evidente un patrón similar (Cuadro 3). Hauler y Carter (2001) recopilaron los datos disponibles sobre los requisitos de lisina de las especies de peces y concluyeron que, a pesar de la gran variación de los requisitos de lisina, los requisitos por unidad de masa corporal se mantuvieron relativamente estables, estimándose en 18,5 g de lisina por kg de pescado entero. -peso corporal. Kaushik y Seiliez (2010), utilizando un metaanálisis de los datos disponibles sobre el requerimiento de lisina y metionina en los salmónidos, pudieron dibujar patrones similares de dosis-respuesta independientemente de la especie.
Para las especies de peces marinos, el metaanálisis de los datos disponibles sobre los requisitos de lisina, metionina y arginina para los peces marinos se presenta en las figuras 2, 3 y 4. Para el otro EAA, debido al número limitado de estudios, no fue posible realizar este enfoque. Se utilizó el modelo cinético de saturación de cuatro parámetros (Mercer et al. 1984) para analizar los datos de respuesta a la dosis.
La condición experimental, la tasa de crecimiento y el peso corporal inicial difieren mucho entre los estudios y, por lo tanto, fue necesario estandarizar el criterio de respuesta en relación con la ganancia de peso máxima o el coeficiente de crecimiento térmico máximo dentro de cada estudio.
Esta estandarización es necesaria para una comparación directa entre estudios de los datos de crecimiento, debido a las diferencias en el tamaño de los peces, la duración del rastro y la magnitud del crecimiento somático en términos absolutos. Para la lisina, la metionina y la arginina se utilizó una compilación de 17, 11 y 16 estudios, respectivamente (véanse las tablas 4, 5 y 6, respectivamente, para referencias). A pesar de la escasez de estudios sobre los requisitos de EAA para peces marinos, los datos utilizados para este metanálisis encajaron relativamente bien con el modelo utilizado.
Con base en este metanálisis, se estimó que el requerimiento de lisina, metionina y arginina en la dieta para alcanzar el 95 % del aumento de peso máximo de los peces era: 4,90 y 5,42 (g/16 g N) para la lisina (Fig. 2); 2,41 y 2,74 (g/16g N) para metionina (fig. 3) y 4,54 y 4,73 (g/16g N) para arginina (fig. 4).
Los valores del metanálisis obtenidos para los requerimientos de lisina y metionina encajan bien con la evaluación de los requerimientos individuales de dosis-respuesta (rango de 3,3 a 56,5 y de 2,3 a 4,5 g/16 g N para lisina y metionina, respectivamente; Tabla 4 y 5). El requerimiento de arginina estimado por el metanálisis también estuvo dentro de los valores obtenidos en base a estudios de dosis-respuesta (rango de 3,8 a 8,1 g/16 g N; Tabla 6), pero aunque alto, el valor de R que explica la aptitud de los datos de arginina fue menor que la obtenida para los otros dos aminoácidos. Esta discrepancia puede estar relacionada con el rango de valores utilizados en los estudios de dosis-respuesta utilizados para ajustar los modelos de metanálisis.



Fig 2. Análisis de los datos de la literatura sobre los requerimientos de lisina de las especies de peces marinos (referencias en la Tabla 4)



Fig 3. Análisis de los datos de la literatura sobre los requisitos de metionina de las especies de peces marinos (referencias en la Tabla 5).


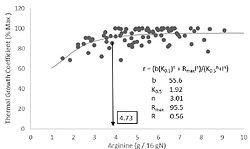
Fig 4. Análisis de los datos de la literatura sobre los requerimientos de arginina de las especies de peces marinos (referencias en la Tabla 6).
Por lo tanto, se requieren más datos para un mejor ajuste del modelo y tener más confianza en los resultados (Fig. 5).
Tabla 4. Datos recopilados de los estudios de requisitos de dosis-respuesta de lisina (Lys).


Tabla 5. Datos recopilados de los estudios de requisitos de dosis-respuesta de metionina (Met).


Proteína ideal
El concepto de proteína ideal es que para una especie, en una determinada etapa fisiológica, existe un perfil dietético óptimo de EAA que satisface las necesidades de mantenimiento y producción y maximiza la retención de nitrógeno (Boisen, 2003). Una proteína con este perfil EAA óptimo se considera una "proteína ideal". En esta proteína ideal, cada EAA se puede calcular como una proporción de la cantidad total de EAA (proporción A/E = contenido de EAA/contenido total de EAA, incluidas la cisteína y la tirosina).
Por lo tanto, los requisitos cuantitativos de todos los EAA se pueden estimar en función de la relación A/E, siempre que se conozca el requisito de un solo EAA. Los requisitos de EAA de todos los demás EAA se expresan entonces como una proporción del EAA de referencia de acuerdo con la proporción relativa de cada uno en el perfil óptimo de EAA.
Tabla 6. Datos recopilados de los estudios de requerimiento de arginina (Arg) de dosis-respuesta.


La estimación de los requisitos de EAA basada en el concepto de proteína ideal es un enfoque muy versátil que se utiliza ampliamente en cerdos (Boisen, 2003) y aves de corral (Baker, 2003). Este enfoque proporciona información fiable y rápida de los requisitos de EAA, y es más económico que el método clásico de dosis-respuesta, y permite que las modificaciones en los requisitos para todos los EAA relacionados con la edad/tamaño del animal, las condiciones fisiológicas o ambientales se puedan estimar fácilmente evaluando cambios en el requerimiento de un solo aminoácido. Para obtener resultados consistentes con este enfoque, se requiere que se obtenga información confiable sobre el perfil óptimo de EAA para el animal y que se establezca con precisión el requisito del EAA utilizado como referencia (Boisen, 2003).
La lisina se ha utilizado como AA de referencia en casi todos los estudios que utilizan el enfoque de la proteína ideal, porque este AA se utiliza principalmente para la acumulación de proteínas; carece de interacciones metabólicas con otros AA; sus requisitos suelen ser los más altos entre los EAA; y generalmente es el primer AA limitante en las dietas prácticas, por lo que es el más susceptible de afectar la eficiencia de la utilización de proteínas y, en última instancia, el crecimiento (Ball et al. 2007). Debido al papel de la lisina como EAA de referencia, su requisito debe definirse con la mayor precisión posible para evitar sesgos en la estimación de los otros requisitos de EAA basados en el enfoque de proteína ideal.

Fig 5. Comparación del perfil EAA, expresado en relación con la lisina (=100), de huevas de pescado, músculo y cuerpo entero de diferentes especies, harina de pescado LT y requerimiento de dorada (datos de Mambrini y Kaushik, 1995; Peres & Oliva -Tele, 2009).
Se han utilizado diferentes perfiles de EAA como indicativos del perfil dietético óptimo de EAA, como huevo de pescado entero, larvas de pescado entero, músculo de pescado o canal de pescado entero (Mambrini y Kaushik, 1995; Fig. 3). Entre ellos, la composición de los tejidos de todo el cuerpo parece ajustarse mejor al perfil de requisitos dietéticos de EAA y, por lo tanto, generalmente se usa para establecer el perfil óptimo de EAA. Esto, aunque el AA de todo el cuerpo refleja mejor el EAA requerido para la acumulación de proteínas y no tener en cuenta los requisitos de AA de mantenimiento (Peres y Oliva-Teles, 2009). Sin embargo, los requisitos de AA de mantenimiento generalmente representan una pequeña fracción de los requisitos totales de EAA (Fournier et al. 2001; Lall 2005). La composición de EAA de cuerpo entero de especies de peces marinos seleccionadas se presenta en la tabla 7. Mambrini y Kaushik (1995), usando un análisis factorial, compararon los datos de EAA disponibles en la literatura.
Estos autores observaron que aunque las proteínas de diferentes tejidos tienen diferentes perfiles de EAA, el perfil de EAA de un tejido dado parece converger entre especies y no se ve afectado por factores como la temperatura, la tasa de alimentación o el tamaño de los peces. Los autores también concluyeron que el perfil EAA de cuerpo entero reflejaba mejor el perfil EAA óptimo de una proteína de referencia.
Otros estudios con especies marinas también sugieren que el patrón de EAA de peces enteros se correlaciona mejor con los requisitos de EAA, aunque no es completamente satisfactorio para algunos peces (Rollin et al. 2003; Alam et al., 2005; Luo et al. 2008; Peres &Oliva-Teles, 2009). Para la lubina y la platija japonesa, se observó que el perfil de EAA de la harina de pescado reflejaba mejor el patrón de requerimiento de EAA que el perfil de EAA de cuerpo entero (Alam et al. 2002; Peres & Oliva-Teles, 2007; Figura 5). Sin embargo, para la dorada, Peres y Oliva-Teles (2009) observaron que el perfil de EAA determinado por el método de eliminación se correlaciona estrechamente con la composición de EAA de cuerpo entero de la dorada.
El perfil EAA óptimo también puede determinarse mediante el método de eliminación. Este método fue descrito inicialmente por Wang y Fuller (1989) y se basa en el concepto de que cada EAA limita igualmente la acumulación de proteínas, es decir, la tasa de acumulación de proteínas corporales está directamente relacionada con el EAA limitante único y la reducción de un EAA no limitante. no tiene efecto sobre la ganancia de nitrógeno. Por lo tanto, los cambios en la ganancia de nitrógeno debido a la eliminación parcial de un EAA en una dieta equilibrada en su perfil de EAA darán una estimación del requerimiento de ese solo EAA. La aplicación de este método a todos los EAA implicará la formulación de una dieta de control, con un perfil equilibrado de EAA, y diez dietas de prueba idénticas a la dieta de control, pero reemplazando alrededor del 40-50 % de un solo EAA por una mezcla de no EAA. manteniendo toda la dieta isonitrogenada. La reducción proporcional en la retención de nitrógeno de cada dieta de prueba en relación con la dieta de control se usa para cuantificar la cantidad de cada EAA de la dieta de control que se puede eliminar sin afectar la retención de N (Fig. 6).
Tabla 7. Composición de aminoácidos (g/16 g N) del tejido corporal total de algunas especies de peces marinos¹

Este enfoque se usa ampliamente en cerdos (NRC, 1998), pero en peces solo se aplicó a salmónidos (Green %Hardy, 2002; Rollin et al. 2003), pargo negro plateado (Sparidentex hasta), tilapia (Diogenes et al. . 2016) y a la dorada (Peres & Oliva-Teles, 2009) (Fig. 7).
La comparación de los perfiles de EAA obtenidos mediante la aplicación del método de eliminación de aminoácidos indica solo pequeñas diferencias entre las especies de peces. La mayor diferencia está en el requerimiento de arginina, que es mayor en la dorada que en los salmónidos. Del mismo modo, también se estimó un mayor requerimiento de arginina por g de acumulación de nitrógeno para las especies de peces marinos (1,04-1,11 g; dorada, lubina y rodaballo) que para la trucha arco iris (0,86 g) (Fournier et al. 002).
El requerimiento de EAA estimado para diferentes especies de peces marinos usando diferentes enfoques se resume en la tabla 8. Como puede verse, para la dorada los requerimientos de EAA estimados por el método de eliminación o por la composición de cuerpo entero son muy consistentes, excepto para Phe + Tiro En animales de rápido crecimiento.
La acumulación diaria de un EAA específico en el cuerpo entero de los peces alimentados también se ha utilizado para determinar experimentalmente los requisitos de EAA.
Este enfoque se aplicó a la tilapia, la carpa, el esturión blanco y siberiano (Ogino, 1980; Jauncey et al. 1983; Kaushik et al. 1991; Ng & Hung, 1995). Aunque este método generalmente proporciona una buena estimación del perfil dietético óptimo de EAA, su aplicación para estimar el requerimiento de AA para el crecimiento es cuestionable. Los valores de los requisitos de EAA obtenidos por este método suelen ser más bajos que los valores obtenidos por los estudios de dosis-respuesta.
Esto se debe a que este método ignora los requisitos de mantenimiento y la eficiencia neta de retención de nitrógeno que representa solo del 30 al 40% del nitrógeno de la dieta.
Dada la escasez de información publicada sobre el requerimiento de EAA para las especies de peces marinos, la aplicación del enfoque de proteína ideal parece una buena estrategia, ya que es una forma rápida y práctica de estimar el patrón de EAA en la dieta y optimizar el nivel de proteína en la dieta. Esta información será muy beneficiosa para el desarrollo de dietas innovadoras de bajo costo y bajo impacto ambiental al minimizar el exceso de proteína en la dieta y la excreción de nitrógeno. Esta información también es crítica para una correcta formulación de dietas basadas en fuentes de proteínas alternativas a la harina de pescado.

Fig 6. Aplicación del método de eliminación de aminoácidos: efecto de la eliminación del 45% de cada EAA de la dieta control sobre la retención de nitrógeno de la dorada (Peres & Oliva-Teles, 2009).

Fig. 7. Comparación del perfil óptimo de EAA, determinado por el método de eliminación, para dorada, trucha arco iris y salmón (datos presentados en relación con el nivel de lisina = 100).
Los aminoácidos como ingredientes funcionales
El principal destino de los AA es la síntesis de proteínas, una pequeña proporción se usa para diferentes funciones fisiológicas, pero la evidencia emergente muestra que algunos AA tienen propiedades que promueven el crecimiento y la salud más allá de su función básica en el cuerpo (Wu, 2010a). Estos AA se conocen como AA funcionales y regulan vías metabólicas clave que son cruciales para el mantenimiento, el crecimiento, la reproducción y las respuestas inmunitarias (Li et al. 2007; Wu, 2010a; Andersen et al. 2016).
Tabla 8. Estimación del requerimiento de aminoácidos esenciales para especies de peces marinos seleccionadas.

La modulación dietética de la salud, el estrés y la respuesta inmunitaria por parte del AA ya se ha confirmado en humanos y animales terrestres mediante la suplementación dietética con AA funcional a niveles superiores a los necesarios para el crecimiento (Li et al. 2007). Este enfoque es particularmente interesante ya que el uso de antibióticos y tratamientos quimioterapéuticos en la acuicultura ahora está altamente regulado y restringido.
Aunque se sabe poco sobre los peces, estudios recientes demostraron que la arginina, la glutamina, la taurina, la metionina, el triptófano, la prolina y la hidroxiprolina pueden tener propiedades funcionales para promover el crecimiento, el desarrollo y la salud de los peces (Li et al. 2007; Andersen et al. 2016).
La arginina y la glutamina son los mejores prototipos de AA funcional, pudiendo modular la función inmunológica, el estado redox celular y la integridad gastrointestinal y, en consecuencia, el estado de salud (Li et al. 2009; Oehme et al. 2010, Andersen et al. 2016).
La arginina tiene importantes funciones reguladoras en el metabolismo de los nutrientes y la respuesta inmunitaria, siendo de relevancia fisiológica en animales enfermos y en situaciones de estrés en las que hay un agotamiento del nivel de arginina en la sangre. Además, los niveles de arginina libre en plasma disminuyen en peces bajo condiciones estresantes en comparación con peces no estresados (Aragão et al. 2008, Costas et al. 2008). En los peces de agua dulce, se ha informado que la arginina es un factor clave de procesos importantes como la producción del precursor fundamental de la síntesis de poliaminas, que mejora el crecimiento de los peces (Li et al. 2009; Cheng et al. 2012; Andersen et al. 2013; Pohlenz et al. 2014; Yue et al. 2015), la producción de óxido nítrico que aumenta la respuesta inmune y la resistencia a enfermedades durante el estrés (Buentello & Gatlin, 1999; 2001; Buentello et al. 2007; Pohlenz et al. 2012a; 2014; Yue et al. 2015) y señalización celular (Bronte y Zanovello, 2005; Holen et al., 2014). También en las especies de peces de agua dulce, la arginina se conoce como un metabolito insulinotrópico más potente que la glucosa, aumentando los títulos de insulina, IGF-1, hormona del crecimiento, glucagón y péptido-1 similar al glucagón (Mommsen et al. 2001; Pohlenz, et al. 2013; Andersen et al. 2014). En especies de peces marinos, se demostró que la suplementación con arginina en la dieta más allá de los requisitos para la síntesis de proteínas promueve el crecimiento (Cheng et al. 20111) y provoca cambios positivos en varios componentes del sistema inmunitario innato (Tafalla & Novoa, 2000; Cheng et al. 2011; Costas et al. 2011; Han et al. 2013), estado oxidativo y maduración intestinal en la lubina (Peres et al. 1997) y niveles reducidos de cortisol en peces estresados (Costas et al. 2013). Por el contrario, recientemente se observó que en dorada la suplementación con arginina no tiene efecto sobre el crecimiento y la utilización del alimento (Coutinho et al. 2016b; Oliva-Teles et al. 2017), la capacidad de absorción intestinal de nutrientes, el metabolismo de aminoácidos y el estrés oxidativo (Coutinho et al. 2016b; Oliva-Teles et al. 2017). et al. 2016b). Además, para el pámpano dorado, se observó que un exceso de arginina, más allá del nivel requerido, conduce a una reducción del rendimiento del crecimiento y la eficiencia de utilización de proteínas (Lin et al. 2015). Los niveles excesivos de arginina pueden generar antagonismo con la lisina, afectando la absorción de lisina (Berge et al. 1999; Kaushik et al. 1988), o pueden aumentar la ureagénesis (Kaushik & Fauconneau, 1984; Oliva-Teles et al. 2017).
La glutamina se considera un aminoácido fundamental que regula varias vías metabólicas, incluido el estrés y las respuestas inmunitarias (Li et al. 2009, Andersen et al. 2016; 46, 29, 65, 63). La glutamina se utiliza como fuente de energía para la síntesis de nucleótidos por todas las células que proliferan rápidamente, incluidos los enterocitos y los linfocitos. Además, se sabe que la glutamina estimula la síntesis de proteínas musculares en los mamíferos y mejora la maduración y la salud del tracto gastrointestinal. Al ser el precursor del glutatión, la glutamina también es importante para proteger las células del estrés oxidativo (Li et al. 2007). En humanos y animales domésticos, los beneficios de la suplementación dietética con glutamina están bien documentados e incluyen beneficios sobre el crecimiento, la conversión alimenticia, la función inmunológica, el estado antioxidante celular y el mantenimiento de las funciones gastrointestinales y la integridad (Wu et al. 2010b). Aunque hasta el momento se han realizado pocos trabajos en esta área en peces, existen evidencias recientes que abren la posibilidad de extender estos beneficios a la producción pesquera. Los estudios con tilapia, carpa Jian y lubina rayada híbrida confirmaron que la suplementación de la dieta con glutamina aumentó significativamente el crecimiento, la función y la estructura intestinal (Yan & Qiu-Zhou, 2006; Lin & Xiau, 2006; Silva et al. 2010; Cheng et al. 2012). ; Jiang et al. 2015; Hu et al. 2015). Además, se ha observado que la suplementación con glutamina aumenta la producción de macrófagos de anión superóxido, radical oxidativo de neutrófilos y actividad de lisozima (Cheng et al. 2011; 2012) y tiene un efecto protector contra el estrés oxidativo en las células epiteliales intestinales y el estrés por hipoxia (Chen et al. 2009; Liu et al. 2015). También se confirmó que la suplementación dietética con arginina más glutamina aumentó significativamente la tasa de alimentación y el crecimiento durante el primer otoño (Oehme, et al. 2010). Los estudios in vitro también mostraron que la glutamina promovió el crecimiento de enterocitos de peces (Jiang et al. 2009) y aumentó la proliferación de células T y B no específicas (Pohlenz et al. 2012b). Recientemente, se observó que el crecimiento y la utilización del alimento de los juveniles de dorada no se vieron afectados por la suplementación con glutamina en la dieta (Caballero-Solares et al. 2015; Coutinho et al. 2016), pero aumentó la retención de proteínas (Caballero-Solares et al. . 2015), y respuestas antioxidantes hepáticas e intestinales moduladas (Coutinho et al. 2016c).
Más allá de sus roles como sustratos para la síntesis de proteínas, la metionina y la cisteína están involucradas en numerosos roles en el metabolismo, siendo donantes de metilo para varias reacciones de metilación, incluido el ADN, y precursores de moléculas importantes, como el glutatión y la taurina, que son compuestos esenciales en los mecanismos de defensa. contra el estrés oxidativo (Metayer et al. 2008; Andersen et al. 2016; Coutinho et al. 2017). En juveniles de lobina rayada híbrida, se observó que la deficiencia de metionina en la dieta podría agotar las reservas de defensas antioxidantes no enzimáticas, como el ácido ascórbico, la vitamina E o el glutatión, y aumentar la oxidación de los lípidos del hígado. La oxidación de los residuos de metionina también actúa como eliminador de especies reactivas de oxígeno (Weissbach et al. 2005; Métayer et al. 2008; Feng et al. 2011).
Juntas, estas repercusiones negativas pueden provocar estrés oxidativo (Li et al. 2009; Andersen et al. 2016). En situaciones de estrés, se informó una disminución de la metionina libre en plasma, lo que sugiere un mayor uso de este AA, probablemente relacionado con la mayor demanda de glutatión y taurina (Aragão et al. 2008; Costas et al. 2010). Sin embargo, en la dorada, la suplementación dietética de metionina por encima del nivel requerido no fue necesaria para mantener los niveles normales de glutatión hepático (Perez-Jimenez et al. 2012). En la lubina europea se demostró que modula la respuesta al estrés oxidativo pero no afecta el rendimiento del crecimiento (Coutinho et al. 2017).
La taurina y la hidroxiprolina son AA no proteicos que abundan en la harina de pescado pero no en las fuentes de proteína vegetal. La taurina se considera un EAA condicional, especialmente para las especies de peces marinos alimentados con dietas bajas en harina de pescado, y está involucrada en funciones biológicas importantes, como la digestión de grasas, la conjugación de sales biliares, la defensa antioxidante, la osmorregulación, así como el desarrollo de funciones visuales, neurales y sistemas musculares (Li et al. 2009; El-Sayed, 2014; Salze et al. 2015). La capacidad para biosintetizar taurina depende de las especies de peces, y para algunas especies carnívoras se requiere la suplementación de dietas bajas en harina de pescado con taurina para maximizar el crecimiento (Goto et al. 2001, 2003; Park et al. 2002; Matsunari et al. 2005, 2008; Takagi et al. 2010; Jirsa et al. 2014; Wu et al. 2015; Lopez et al. 2015; Al -Feky et al. 2016; Li et al. 2016b). También se sabe que las dietas deficientes en taurina deterioran la función hepática (El-Sayed, 2014; Salze et al., 2015), lo que induce síntomas de hígado verde en especies de peces carnívoros como el besugo, el jurel y la platija japonesa (Takagi et al. 2006, 2008, 2011; Goto et al. 2001). El papel de la taurina en la digestión de lípidos y la formación de sales biliares está bien documentado (Salze & Davis, 2015). En el pescado, las conjugaciones de ácidos biliares ocurren principalmente con taurina; los ácidos biliares conjugados se absorben activamente en el intestino distal, manteniendo así concentraciones adecuadas en la mayor parte del intestino (Salze & Davis, 2015). Un nivel bajo de taurina puede afectar la conjugación de los ácidos biliares y, por lo tanto, la digestión de los lípidos. La evidencia muestra que la suplementación con taurina aumenta el contenido de sales biliares (Kim et al. 2007, 2015; Nguyen, et al. 2015), aunque parece ser independiente de los niveles de lípidos en la dieta (Kim et al. 2008; Salze et al. 2015).
El aumento de las evidencias también ha destacado el papel de la taurina como antioxidante (El-Sayed, 2014; Salze et al. 2015). La depleción de taurina puede inducir estrés oxidativo e inflamatorio (El-Sayed, 2014; Salze et al. 2015. La acción antioxidante de la taurina puede estar asociada a su capacidad para actuar como un eliminador no específico de especies reactivas de oxígeno, para modular la producción de oxígeno reactivo especies o para mejorar la actividad de la enzima antioxidante (Divakaran, 2006; Aydogdu et al., 2007; Bañuelos-Vargas et al. 2014; Feidantsis et al. 2014; Han et al. 2014).La suplementación con taurina en la dieta redujo la peroxidación lipídica (Zhang et al. 2004; Aydogdu et al. 2007; Chang et al. 2011; Sevgiler et al. 2012; Hammes et al. 2012; Banuelos-Vargas et al. 2014). También se ha informado que la taurina tiene algunos beneficios para la salud, incluido el alivio de toxicidad por metales (Gurer et al. 2001; Sevgiler et al. 2011; Hammes et al., 2012) y resistencia contra la hiperamonemia (Li et al. 2016).
El triptófano es el único aminoácido que se puede convertir en serotonina, el precursor de la melatonina, que tiene varias funciones biológicas importantes, como la regulación del apetito, la respuesta inmunitaria y el mantenimiento de la salud (Andersen et al. 2916). Algunos estudios con animales, incluidos los peces, indican que el triptófano es un factor limitante de la tasa de síntesis de serotonina, lo que induce una respuesta dependiente de la dosis (Johnston et al., 1990; Herrero et al., 2007).
En consecuencia, y aunque el paso limitante de la velocidad de síntesis de melatonina está modulado por las enzimas AANAT y HIOMT, estas reacciones dependen de la concentración de sustrato y, por tanto, el triptófano también actúa como factor limitante de la producción de melatonina (Huether et al. 1992). La suplementación con triptófano en la dieta redujo el comportamiento agresivo en diferentes especies de peces (Winberg et al. 2001; Hodlund et al. 2005; Clotfelter et al. 2007).
Se sabe que el triptófano, a través de sus precursores, la serotonina y la melatonina, actúa como un eliminador de radicales libres y juega un papel clave en el equilibrio redox de las células al promover la actividad de las enzimas antioxidantes, lo que también se observó en las especies de peces (Wen et al. 2014; Ciji et al. 2015). Recientemente, para el lenguado senegalés se ha demostrado que el triptófano tiene propiedades inmunomoduladoras después de un desafío bacteriano (Azeredo et al. 2016), mientras que se observó lo contrario para la lubina (Machado et al. 2015). En la carpa, se observó que un nivel adecuado de triptófano en la dieta mejora el crecimiento de la carpa herbívora, la respuesta inmune intestinal, la función de barrera y el estado antioxidante, y regula los niveles de ARNm de las moléculas señalizadoras relacionadas, mientras que niveles más altos de triptófano reducen severamente el crecimiento (Wen et al. . 2014). La fortificación de la dieta con triptófano también modula el crecimiento y el estado inmunometabólico de los juveniles de Labeo rohita expuestos a nitrito (Ciji et al. 2015).
La prolina y la hidroxiprolina también se consideran condicionalmente EAA para algunos peces tanto en etapas tempranas de vida como adultas, y también tienen propiedades funcionales relacionadas con las respuestas inmunológicas y antioxidantes (Wu et al. 2011). La hidroxiprolina se produce por poshidroxilación de prolina después de la síntesis de proteínas. La suplementación dietética de dietas bajas en harina de pescado con hidroxiprolina mejoró el crecimiento y la formación de colágeno (Aksnes et al. 2008). Sin embargo, para el rodaballo, la suplementación con hidroxiprolina de las dietas basadas en plantas no tuvo efecto sobre el crecimiento, pero aumentó la concentración de colágeno total en los tejidos y en el músculo (Zhang et al. 2013).
Conclusiones
La formulación de la dieta basada en un contenido adecuado de proteínas y un perfil óptimo de EAA es un factor clave para mejorar la eficiencia de la utilización de AA para la acumulación de proteínas y, por lo tanto, reducir la excreción de nitrógeno. Sin embargo, la información sobre el requerimiento de proteínas y particularmente sobre los requerimientos de los 10 EAA considerados clásicamente es limitada para la mayoría de las especies de peces marinos con interés para la acuicultura. Esta falta de información es de relevancia práctica cuando se considera la sustitución de la harina de pescado por proteína vegetal como fuente principal de proteína dietética, debido al potencial desequilibrio de EAA que puede ocurrir.
Hasta ahora, los estudios sobre los requisitos de EAA de los peces marinos se han centrado en un número limitado de EAA, a saber, lisina, metionina y arginina, que son EAA que pueden ser los primeros limitantes en los ingredientes alimentarios más utilizados. Recientemente, y como consecuencia del uso de piensos vegetales como principales fuentes de proteínas en la dieta, se ha prestado especial atención a los requerimientos de taurina. La estimación del requerimiento de EAA basada en el concepto de proteína ideal es un enfoque muy versátil, que permite la estimación del requerimiento de todos los EAA en función de la determinación del requerimiento de solo un EAA y el perfil de EAA de proteína ideal. Debido a la gran diversificación de nuevas especies marinas con interés para la acuicultura, el enfoque de proteína ideal puede usarse como primer enfoque para proporcionar información rápida y relativamente económica sobre los requisitos de EAA.
La mayor proporción de AA se utiliza para la síntesis de proteínas; siendo utilizada una proporción menor para diferentes propósitos metabólicos. En relación con esto, la evidencia emergente muestra que algunos AA, cuando se incorporan en las dietas a un nivel superior a los requisitos, pueden tener propiedades funcionales, regulando vías metabólicas clave cruciales para el mantenimiento, el crecimiento, la reproducción, el estado oxidativo y las respuestas inmunitarias de los animales. Se necesitan más estudios para dilucidar los cambios inducidos por AA y su posible aplicación como moduladores del crecimiento y el bienestar de los peces.