
2.5 Función de los aminoácidos
Los aminoácidos desempeñan un importante papel en el metabolismo celular, ya que todas las reacciones bioquímicas son catalizadas por enzimas constituidas por residuos de aminoácidos. Los aminoácidos son esenciales para el metabolismo lipídico y de carbohidratos, para la síntesis de proteína tisular y de otros compuestos muy importantes (p. ej. adrenalina, tiroxina, melanina, histamina, porfirínas-hemoglobina, pirimidinas y purinas - ácidos nucléicos, colina, ácido fólico y ácido nocitínicovitaminas, taurina-sales biliares, etc.) y como fuente metabólica de energía.
2.6 Requerimientos de aminoácidos
Para propósitos nutricionales, los aminoácidos se pueden dividir en dos grupos; los aminoácidos esenciales (AAE), y los no esenciales (AANE). Los AAE son aquellos que no pueden ser sintetizados dentro del cuerpo animal, o bien no lo son a una velocidad adecuada que permita cubrir las necesidades fisiológicas del animal en crecimiento, y por lo tanto deben ser suministrados en la dieta, en una forma ya elaborada. Los AANE, son aquellos aminoácidos que pueden ser sintetizados en el cuerpo, a partir de una fuente de carbono adecuada y de los grupos amino proveniente de otros aminoácidos o de compuestos simples, como el citrato de amonio, y consecuentemente no tienen que ser suministrados ya elaborados en la dieta.
Los aminoácidos esenciales para peces y crustáceos son:
Treonina Valina Leucina Isoleucina Metionina Triptófano Lisina Histidina Arginina Fenilalaina
A pesar de que los AANE, no son nutrientes esenciales en la dieta, desempeñan una variedad de funciones esenciales a nivel del metabolismo celular. Se les denomina nutrientes dietéticos no esenciales debido únicamente a que el tejido corporal puede sintetizarlos cuando se necesiten. De hecho a menudo se ha señalado que los AANE desde el punto de vista fisiológico son tan esenciales, que el cuerpo asegura un suministro adecuado al sintetizarlos. Desde el punto de vista de una formulación de una dieta, es importante conocer que los AANE cistina y tirosina, pueden ser sintetizados en el cuerpo a partir de aminoácidos esenciales como la metionina y fenilalanina respectivamente y por consecuencia los requerimientos dietéticos para esos AAE estarán en función de la concentración de sus AANE correspondientes en la dieta.
2.6.1 Nivel óptimo de aminoácidos esenciales en la dieta
a) Método de respuesta o la dosis y depositación en el cadáver: Los requerimientos cuantitativos de AAE en peces, tradicionalmente han sido determinados mediante el suministro de dietas experimentales en las que se incluyen niveles graduales de cada aminoácido, de tal modo que se obtienen las curvas de crecimiento respectivas (para revisión consultar Ketola, 1982; Cowey y Luquet, 1983; Wilson, 1985).
El requerimiento dietético es aquel donde cambia el punto de inflexión en la curva de crecimiento observada. Además de utilizar el crecimiento como criterio para estimar los requerimientos de aminoácidos, varios investigadores también han usado el nivel de aminoácidos libres contenidos dentro de un “pool” de algún tejido específico (sangre entera, plasma sanguíneo o músculo; Kaushik, 1979), o bien la oxidación de aminoácidos radioactivamente marcados (administrados oralmente o por inyección; Waltson, Cowey y Adron, 1982).
En las dietas prueba usadas para determinar los requerimientos de aminoácidos, el componente proteínico es suministrado casi en su totalidad en forma de aminoácidos cristalinos o en combinación con fuentes proteínicas “completas” selectas (normalmente caseína, gelatina, zeína, gluten o harina de pescado); el perfil de aminoácidos del componente proteínico total de la dieta se balancea de tal modo que simule el perfil de aminoácidos de una proteína específica de referencia.
En contraste con el método estandar arriba descrito en el que los peces son alimentados con dietas con niveles graduales de aminoácidos, Ogino (1980a) determinó los requerimientos cuantitativos de AAE del pez simultáneamente con la técnica de depositación diaria de aminoácidos individuales en el cadáver del pez. En el método de Ogino, los peces son alimentados con una dieta que contiene una fuente proteíca “completa” de alto valor biológico, y el requerimiento dietético de AAE se contabiliza tomando como base el valor de la depositación diaria de AAE en el tejido.
La Tabla 2 resume los requerimientos cuantitativos conocidos de AAE de peces hasta la fecha estudiados, utilizando para dicha determinación las técnicas arriba mencionadas. Los requerimientos común C. carpio, trucha arco-iris S. gairdneri, bagre de canal I. punctatus, anguila japonesa, A. anguila, y el salmón “chinook” O. tshawytscha). Hasta el momento, no se cuenta con información cuantitativa sobre los requerimientos de AAE del camarón, en principio ello se debe al pobre crecimiento observado en el camarón al sumistrarle dietas prueba a base de aminoácidos sintéticos, así como los problemas inherentes del lavado de nutrientes a causa del tiempo tan largo que les toma a los crustáceos para alimentarse.
Aunque recientemente se han realizado un gran número de estudios independientes sobre los requerimientos de aminoácidos para truchas arco-iris, se ha visto que existen diferencias significativas en los requerimientos (g de aminoácidos/100 g de proteína) dentro y entre las especies individuales (Tabla 2). Por ejemplo diferencias del orden del 114% fueron observadas entre laboratorios independientes, en relación a los requerimientos de lisina, arginina y metionina en crías/juveniles de trucha arco-iris. De igual modo las variaciones interespecíficas fluctuaron desde un 22% para la valina hasta un 122% para el triptofano. Mientras uno podría esperar que los requerimientos cuantitativos de AAE de los peces disminuyeran con la edad y decreciera la síntesis proteíca (crecimiento), uno bien podría cuestionar si las variaciones observadas en los requerimientos son reales o simplemente se trata de artefactos del método empleado. En contraste a las variaciones observadas en los requerimientos de una misma especie de pez, alimentada con dietas prueba convencionales de aminoácidos, no se encontró una diferencia significativa en los requerimientos de AAE, para la carpa y trucha según el método de depositación en el cadáver de Ogino (1980a). Sin embargo, los requerimientos dietéticos observados caen dentro del rango reportado para peces alimentados con dietas prueba de aminoácidos (Tabla 2).
Comparado con el método convencional de alimento con niveles graduales de aminoácidos individuales, el método de depositación en el cadáver desarrollado por Ogino (1980a) ofrece numerosas ventajas:
-
Los peces son alimentados con raciones en las cuales el componente proteínico es suministrado en forma de proteína “completa” y tiene un alto valor biológico. Por lo cual los requerimientos de aminoácidos pueden ser determinados simplemente refiriéndose al grupo de peces que muestren el mejor crecimiento.
-
El requerimiento dietético de los diez AAE puede ser determinado simultáneamente en un solo experimento. Mientras que al usar las dietas convencionales para pruebas de aminoácidos se deben realizar hasta 10 experimentos separados, cada evaluación implica el uso de hasta seis regímenes dietéticos en los que se emplean varias concentraciones dietéticas del único aminoácido que se esté determinando.
-
Los requerimientos cuantitativos de AAE igualmente pueden ser establecidos tanto para peces que inicien su alimentación como para reproductores, sin pérdida alguna en la precisión.
b) Método de análisis en el cadáver: De una manera interesante, la recalculación de los datos obtenidos por Ogino (1980a) muestra que no existe diferencia entre las proporciones relativas de los AAE individuales, requeridos en la dieta y las proporciones relativas de los mismos 10 AAE presentes en el cadáver del pez (Tacon y Cowey, 1985). Una relación similar también se encontró en cerdos y pollos en crecimiento (Boorman, 1980) y en una proporción menor entre las cuatro especies de peces, para las cuales se habían determinado los requerimientos de AAE usando dietas prueba con aminoácidos (Figura 3).
Tabla 2. Requerimientos cuantitativos de aminoácidos esenciales (AAE) de algunas especies selectas de peces. Los valores son expresados en orden, como porcentaje de la proteína en la dieta y como porcentaje en la dieta seca (el denominador representa el porcentaje de proteína en la dieta).



¹ Régimen de alimentación: indica el nivel de alimentación y número de alimentos al día.
² En la presencia de cistina en la dieta (a, 2%; b, 0.24%; c, 1%; d, 1%; e, 0.3%; f, 2%; g, 0.74; h, 1%)
³ En ausencia de cistina en la dieta.
⁴ En presencia de tirosina en la dieta (h,1%; i, 1%; j, 0.4%; k, 2%)
⁵ En ausencia de tirosina en la dieta.

Figura 3. Relación entre el patrón de requerimientos de aminoácidos esenciales, determinado a través de experimentos de alimentación utilizando dietas con niveles variables de aminoácidos, para carpa (), anguila japonesa (), bagre de canal () y salmón “Chinook” () y el patrón de los mismos aminoácidos en el cadáver del pez. El nivel de cada aminoácido, se representa como porcentaje, de la suma de los 10 aminoácidos esenciales en cada patrón. La línea representa la coincidencia entre los requerimientos y el patrón en el tejido.
N.A. Datos no disponibles (no analizados).* Aminoácidos no esenciales. Todos los valores se expresan como porcentaje del total de AAE más la cistina y tirosina.
Similarmente Wilson y Poe, (1985) obtuvieron un coeficiente de correlación de 0.96 al hacer la regresión del patrón de requerimientos de AAE para el bagre de canal contra el patrón de AAE de todo el cuerpo obtenido en bagres de 30 g. Dado que la composición de aminoácidos en el tejido del pez no difiere grandemente (si es que difiere) entre las especies de peces (Njaa y Utne, 1982; Wilson y Cowey, 1985) consecuentemente el patrón de requerimientos para diferentes especies también será similar. Aunque no ha sido probado, es razonable suponer que existe una relación similar entre los camarones y langostinos. Para propósitos comparativos, la Tabla 3 ilustra el patrón de requerimientos de AAE para peces como fue determinado por Ogino (1980a), junto con el patrón de AAE encontrado en el cadáver del tejido corporal del pez, de larvas y juveniles de Penaeus japonicus, juveniles de Penaeus paulensis, tejido de almeja de cuello corto (Venerupis philippnarum; considerada como un excelente e ideal alimento natural para el camarón), y el músculo de la cola de Macrobrachium rosenbergii. En base a los perfiles de aminoácidos, podría parecer que el camarón tiene un requerimiento dietético mayor para la arginina, tritofano y tirosina, y un requerimiento menor para la valina, treonina y lisina, en comparación con los peces.
Dada la carencia de información cuantitativa confiable sobre los requerimientos dietéticos de AAE tanto de camarones como de la mayoría de los peces cultivados; como una primer aproximación, dichos requerimientos se pueden considerar tomando para ello como base el patrón de AAE presente en el cadáver, mismo que deberán estar presentes en un porcentaje de por lo menos 35% de los requerimientos protéinicos conocidos para la especie en cuestión. En términos generales los AAE (incluyendo los AANE cistina y tirosina) constituyen aproximadamente el 35% del total de la proteína dietética requerida pro el pez (Tabla 2). Así, si un camarón o un pez tienen un requerimiento protéinico del 45% entonces el requerimiento de AAE será contabilizado a partir del patrón de AAE presentes en el cadáver y representarán el 35% del nivel proteínico de la dieta. Por ejemplo, si el patrón de AAE del cadáver arrojó un resultado de 16.9% de lisina en relación al total de AAE, incluyendo la cistina y tirosina, entonces el nivel de lisina requerido en la dieta será 45 × 35 × 16.9/10,000 ó 2.66% de la dieta seca (dieta para peces con 45% de proteína).
Como una guía, la Tabla 4 muestra los requerimientos dietéticos de AAE para peces y camarones, calculados a niveles proteínicos variables, basados en el patrón promedio de AAE del cadáver del tejido de todo el pez y de la almeja de cuello corto, respectivamente (en este caso se utilizó el tejido de almeja de cuello corto, en ausencia del patrón de AAE promedio del cadáver de camarones).
2.6.2. Utilización de aminoácidos libres
Los juveniles de peces o camarones alimentados con raciones en las que una porción significativa de la proteína dietética es suministrada en forma “libre” como aminoácidos cristalinos, generalmente muestran un crecimiento subóptimo y una eficiencia de conversión alimenticia baja, comparada con animales alimentados con proteína “entera” o con proteínas en las que los aminoácidos son
Tabla 3. Patrón de requerimientos promedio de aminoácidos esenciales (AAE) (%) y patrón de AAE en el tejido corporal del pez, almeja, camarón y langostino.

elementos constitutivos de estas (Wilson et al., 1978; Robinson et al., Yamada et al., 1981; Walton et al., 1982; Deshimaru, 1981; Deshimaru & Kuroki, 1974a, 1975).
En general, los aminoácidos incorporados a la dieta en forma libre, son asimilados más rápidamente por los peces, en comparación con los aminoácidos que integran la proteína. Experimentos realizados con trucha arco—iris (Yamada et al., 1981(, carpa común (Blakas et al., 1980) y tilapia (Oreochromis niloticus; Yamada et al., 1982) en los que se alimentó con dietas prueba a base de aminoácidos en el plasma sanguíneo de los peces, comparativamente en menor tiempo (12–24h, 2–4h, 2k, respectivamente) que en los peces alimentados con las dietas equivalentes elaborados con caseína (24–36h, 4h, 4h respectivamente). Aún más, en el caso de la carpa los aminoácidos libres son individualmente absorbidos del tracto digestivo en tiempos variables, y en consecuencia los picos de concentración de cada uno de los aminoácidos no se presentan simultáneamente (Plakas et al., 1980).
En camarones juveniles la situación parece ser la contraría. Por ejemplo, Deshimaru (1981) mostró que la tasa de asimilación de arginina libre en la proteína muscular en juveniles de Penaeus japonicus era extremadamente baja (asimilación menor de 0.6%) en comparación con la arginina ligada a la proteína (asimilación por arriba del 90%). Sin embargo, a pesar de que Deshimaru (1981) no reportó un efecto benéfico en el crecimiento de juveniles de P.japonicus alimentados con dietas suplementadas con aminoácidos libres, estudios recientes han demostrado que larvas de la misma especie son capaces de utilizar eficientemente dietas suplementadas con aminoácidos (Teshima, Kanazawa & Yamashita, 1986).
Para que una síntesis proteínica óptima tenga lugar, es necesario que todos los aminoácidos (bien sean obtenidos de fuentes proteínicas enteras o sean suplementados a la dieta) estén presentes simultáneamente en el tejido. Si dicho equilibrio no es alcanzado, entonces sobreviene un catabolismo (desdoblamiento) de los aminoácidos, reflejándose en una disminución en el crecimiento y en la eficiencia alimenticia. Por consecuencia, para las especies de agua caliente, caracterizadas por una rápida captación y asimilación de aminoácidos libres, es fundamental que se de agua de las siguientes condiciones: (1) que la liberación o absorción de aminoácidos libres obtenidos a partir del alimento sea reducida, de tal modo que minimice las variaciones observadas en la tasa de observación de los aminoácidos libres y los aminoácidos que integran la proteína (lo cual se puede lograr al cubrir los aminoácidos libres con caseína o membranas proteícas de nylon; Murai et al., 1982; Teshima, Kanazawa & Yamashita, 1986); ó (2) que la frecuencia de alimentación se incremente de dos a tres alimentos por día, hasta un máximo de 18 veces al día, de tal modo se minimicen las variaciones observadas en la concentración de aminoácidos en el plasma sanguíneo (Yamada, Tanaka & Katayama, 1981).
2.6.3 Composición de aminoácidos y calidad de proteína
Tomando como base las discusiones precedentes, resulta evidente que la calidad de la proteína en los ingredientes alimenticios depende de la composición de aminoácidos que la caracterizan y de la disponibilidad biológica de los mismos. En general, entre más se aproxime el patrón de AAE de la proteína a los requerimientos dietéticos de AAE de la especie en cuestión, mayor será su valor nutricional y utilización. Por ejemplo, la Tabla 5 presenta el “valor químico” o el valor proteínico potencial de algunos alimentos proteínicos comúnmente utilizados. Un valor químico de 100 indica que el nivel de algún AAE en particular presente en el alimento proteínico es idéntico al nivel de ese AAE requerido por el pez cuando se expresa como porcentaje del total de aminoácidos esenciales más la cistina y tirosina, como fue determinado por Ogino (1980a). El valor químico de la proteína, es considerado como el porcentaje de AAE en mayor déficit en relación al patrón de requerimientos dietéticos. Este método de evaluación de la calidad proteínica, está basado en el concepto de que el valor nutritivo de una proteína depende primariamente de la cantidad de AAE presentes en menor cantidad en esa proteína en particular, comparada a la proteína de referencia (en este caso, la proteína de referencia es el requerimiento de AAE en la dieta del pez, determinados por el método de Ogino, 1980a). En la Tabla 5 se puede ver que la mayoría de las fuentes proteínicas mostradas, presentan una proporción no adecuada de aminoácidos esenciales, en comparación con el perfil de AAE de la harina o músculo de pescado; caracterizados por su apropiado balance y elevado valor químico (c. 80), situación que se traduce en que la mayoría de dichas fuentes proteínicas, por si solas sean inapropiadas como fuente proteínica para peces que mantenidos bajo sistemas de explotación intensivos demandan de una dieta completa. El objetivo de la formulación de raciones es mezclar proteínas con diferente calidad y obtener el patrón de AAE deseado para la especie de pez o camarón en cuestión (alimentación con dietas completas).
Tabla 4. Requerimientos de AAE a incluir en la dieta de peces y camarones, calculados a diferentes niveles proteínicos (valores expresados como porcentaje de la dieta seca)


¹ Patrón de AAE en el cadáver del tejido de peces (Wilson & Cowey, 1985).
² Patrón de AAE en el cadáver de almeja (Deshimaru et al., 1985)
* Aminoácidos no esenciales.
Sin embargo la relación de arriba, entre la calidad de la proteína y el patrón de AAE únicamente será valido si los aminoácidos individuales tienen entre si la misma disponibilidad biológica para el animal.
Por ejemplo, bajo ciertas condiciones algunos de los aminoácidos pueden no estar disponibles debido a que las proteínas en la dieta estén parcialmente digeridas. Así, para camarones y peces carnívoros la pared celulósica de las fuentes proteínicas vegetales pueden resultar un que las proteínas presentes dentro de la célula no están accesibles a la acción de las enzimas digestivas. En otros casos, la digestión puede ser interferida por la presencia de inhibidores enzimáticos en el mismo material usado como fuente proteínica, como el inhibidor de tripsina presente en el fríjol de soya cruda. Sin embargo, es posible inactivar dichos inhibidores mediante su procesamiento con calor moderado; bajo condiciones de calentamiento excesivo. las proteínas se hacen más resistentes a la digestión, debido a la formación de enlaces peptídicos entre las cadenas laterales de la lisina y el ácido dicarboxílico. Los grupos animo epsilon libres de la lisina, son particularmente susceptibles al daño térmico, dando lugar a la formación de compuestos de adición con entidades químicas no proteínicas (p. ej. glucosa o azúcares reductores) presentes en el material alimenticio (Cockerell, Francis & Halliday, 1972). Esta reacción se conoce como la reacción de Maillard, que termina por dejar biológicamente inaccesible a la lisina. Otras sustancias diferentes a los azúcares reductores que se sabe reaccionan con el grupo amino epsilon libre de la lisina incluyen el gossypol y compuestos fenólicos presentes en la harina de algodón. Una estimación de la disponibilidad biológica de aminoácidos en los alimentos proteínicos y por ende, un indicador de la calidad proteínica puede obtenerse a través de la determinación química del contenido de lisina libre disponible en dichos alimentos (Cowey, 1979).
2.7 Evaluación de la calidad proteínica
Además de la determinación química de los aminoácidos y de su disponibilidad en los alimentos, existentes muchos métodos biológicos para evaluar la calidad proteínica:
Tasa de crecimiento específica (T. C. E). La tasa de crecimiento de un animal, es un indicador bastante sensible de la calidad proteínica; así bajo condiciones controladas la ganancia en peso está en proporción a los aminoácidos esenciales suministrados. La T. C. E. diaria puede ser calculada con la siguiente fórmula:
T.C.E. =(loge peso corporal final - loge peso corporal inicial) / período de tiempo en días × 100
Factor de conversión de alimento (F.C.A.). Definido como los gramos de alimento consumido, por cada gramo de peso corporal ganado.
F.C.A. = Alimento ingerido* / peso ganado**.
* Como alimento seco suministrado.
** Peso fresco o húmedo ganado.
Eficiencia alimenticia (E.A.). Definida como los gramos de peso ganado por gramo de alimento consumido. Sus unidades de expresión son las mismas que en el caso anterior.
E.A. = Peso ganado / alimento ingerido.
Tasa de eficiencia proteínica (T.E.P.). Definida como los gramos de peso ganado, por gramo de proteína consumida.
T.E.P. = Peso ganado* / proteína consumida.
* Con este método no se considera la utilización de la proteína para el mantenimiento, ya que el método presupone que toda la proteína es utilizada para el crecimiento.
Utilización proteínica neta aparente (U.P.N.A.). Definida como el porcentaje de proteína ingerida, que es depositada como proteína tisular.
U.P.N.A. = Pb - Pa / Pi × 100.
Donde: Pb es el total de la proteína corporal al final del ensayo de alimentación. Pa es el total de la proteína corporal al inicio del ensayo de alimentación y Pi es la cantidad de proteína consumida durante el ensayo de alimentación.
En esta determinación, no se consideran las pérdidas proteínicas endógenas. En contraste con los métodos previos para evaluar la calidad proteínica, este método requiere de una muestra representativa de organismos sacrificados tanto al inicio como al final del ensayo, para realizar la determinación proteínica en el cadáver.
¹ Score basado en la comparación de los requerimientos promedio de aminoácidos esenciales (AAF) de trucha arco-iris y carpa (Ogino, 1980).
Los requerimientos promedios de AAF(expresados como % del total de AAF) son: Trionina 10.6; Valina 9.5; Metionionina 5.4; Cistina 2.7; Isoleucina 7.5; Leucina 13.5; Fenilalanina 9.5; Tirosina 6.5; Lisina 16.8;Arginina 11.6; Triptofano 1.7 e Histidina 4.8.
² Fuentes: 1-Kay (1979); 2- Gohl (1980); 3- Bolton and Blayr (1977); 4- National Research Counsil (1983); 5- Tunnel AVEBE Starches Ltd., UK; 6- Cowey et al., (1971); 7- Datos opublicados; 8- Cowey and Sargent (1972); 9- Connell and Howgate (1959); 10- Jackson, Kerr and Cowey (1984); 11- Tacón, Stafford and Edwards (1983); 12- Spindelli (1980)
* Aminoácidos esenciales (presentes por debajo del 30% del requerimiento promedio del pez).
La principal desventaja de estos métodos para predecir la calidad proteínica de la dieta es que deben realizarse bajo condiciones experimentales controladas, en ausencia de los organismos presentes en el alimento natural. Consecuentemente, los resultados generados únicamente se pueden aplicar en sistemas de cultivo intensivo o de agua clara.
2.8 Constituyentes nitrogenados no proteínicos
Los aminoácidos son importantes no sólo como unidades para la formación de proteínas sino que además son los constituyentes primarios o precursores nitrogenados de muchos compuestos nitrogenados no proteínicos. La Tabla 6 enlista algunos compuestos nitrogenados no proteínicos, biológicamente importantes que se forman a partir de los aminoácidos.
2.9 Patologías causadas por proteínas y aminoácidos
2.9.1 Deficiencias dietéticas de aminoácidos esenciales
Aunque todos los peces examinados hasta la fecha mostraron una disminución en el crecimiento al ser mantenidos con dietas deficientes en AAE, los siguientes signos anatómicos causados por deficiencia se han observado en condiciones experimentales, en juveniles de peces, al ser alimentados con raciones sintéticas deficientes en uno o más AAE.
En condiciones de cultivo intensivo, se puede presentar una deficiencia de AAE, por alguna de las siguientes cuatro causas:
-
Una pobre formulación del alimento, debido al uso de cantidades desproporcionadas de proteínas con deficiencias naturales de algún AAE específico (Tabla 5).
Tabla 5. Score químico y aminoácidos esenciales limitantes de algunos alimentos proteínicos comúnmente utilizados¹


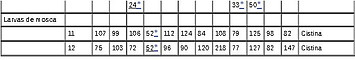
Tabla 6. Constituyentes nitrogenadosno proteicos, derivados de los aminoácidos en los animales¹


¹ Lloyd, Mc Donald & Crampton (1978)
² Se ha sugerido que la pirimidina y purina son nutrientes esenciales para alevines de peces recién eclosionados (Dabrowski & Kaushik, 1982) y Artemia salina (Hernandorena, 1983), respectivamente.
También puede presentarse un desequilibrio dietético, debido a la presencia de niveles desproporcionados de aminoácidos específicos, incluyendo antagonismos entre aminoácidos como leucina/isoleucina, y en menor grado arginina/lisina y cistina/metionina.

¹ 1- Walton, Cowey y Adron (1984); 2- Ketola (1983); 3- Mazid et al., (1978); 4- Walton, Cowey y Adron(1982); 5- Poston et al., (1984); 8-Kloppel y Post (1975); 9- Poston y Rumsey (1983); 10- Shanks, Gahimery Halver (1962); 11- Halver y Shanks (1960); 12- Akiyama et al., (1985a).
² Curvatura de la columna vertebral.
Por ejemplo la harina de sangre es una fuente rica de valina, leucina e histidina, pero es una fuente pobre de metionina e isoleucina. Sin embargo en vista del efecto antagonistico de un exceso de leucina sobre la isoleucina, los animales alimentados con niveles elevados de sangre, manifiestan signos de deficiencia por isoleucina, causada por un exceso de leucina en la dieta (Taylor, Cole and Lewis, 1977).
Aunque se ha reportado un antagonismo similar para la cistina/metionina (por el uso de harina de pluma hidrolizada; Ichhponani y Lodhi, 1976) y arginina/lisina (Harper, Benevenga y Wohlueter, 1970) en los animales terrestres cultivados; sin embargo no se ha detectado su ocurrencia en peces alimentados con dietas que incluyan la combinación de aminoácidos sintéticos (Robinson, Wilson y Poe, 1981).
-
Una deficiencia de AAE, puede ocurrir por un calentamiento excesivo de las proteínas en el alimento, durante su elaboración.
-
Una deficiencia de AAE, puede ocurrir a partir del tratamiento químico de las proteínas en el alimento con ácidos (producción de ensilado) o con un álcali o base debido a la pérdida del triptófano libre y de lisina/cistina, respectivamente (Kies, 1981).
Una deficiencia de AAE, puede ocurrir por el lavado de aminoácidos, tanto libres como aquellos que forman parte de una proteína. Por ejemplo, Grabner, Wieser y Lackner (1981) reportaron la pérdida por lavado, de casi todos los aminoácidos libres y do aproximadamente 1/3 de los aminoácidos libres y que integren a las proteínas en el zooplancton congelado o en seco (Artemia salina y Moina spp.) respectivamente, después de 10 min. de inmersión en agua a 9°C. También se han observado pérdidas considerables de aminoácidos solubles al agua en la carpa, durante la masticación del alimento (Yamada y Yone, 1986).
Sin embargo, el problema de lavado de nutrientes de materiales hidrosolubles es más grave para crustáceos, debido a su hábito de alimentación demersal excesivamente lento y de la necesidad de masticar externamente su alimento antes de ingerirlo (Farmanfarmaian, Lauterio e Ibe, 1982). Por ejemplo Bages y Sloane (1981) reportaron una pérdida proteínica del 28% durante la preparación y rehidratación de dietas de camarón ligadas con alginatos, antes de la alimentación y una pérdida proteínica total del 39=47%, después de un período de inmersión de 6 horas en agua de mar. En general, las pérdidas de nutrientes son mayores en agua dulce que en agua de mar (Balazs, Ross y Brooks, 1973). Sin embargo, el problema de lavado de nutrientes se puede minimizar siguiendo un régimen de alimentación adecuado (una mayor frecuencia de alimentación; Sedwick, 1979) y con una apropiada técnica de aglutinación o microencapsulación (Goldblatt, Conklin y Duane Brown, 1980; Jones et al., 1976).
2.9.2 Toxicidad de aminoácidos no esenciales
La ocurrencia de patologías nutricionales puede presentarse a causa de la ingestión de proteínas que contengan aminoácidos tóxicos.
Las proteínas dietéticas comúnmente utilizadas, que se conoce contienen aminoácidos tóxicos, incluyen la soya tratada con álcali (aminoácido tóxico-lisinoalanina), la leguminosa Leucaena leucocephala o “ipil-ipil” (aminoácido tóxico-mimosina), y el haba Vicia faba (aminoácido tóxico-dihidroxifenilalanina).