
11. Bagre de Canal (Ictalurus punctatus) - Dieta seca, migajas/pellets

¹ Premezclas de vitaminas y minerales formuladas para cumplir o exceder las recomendaciones de NRC (1977).
² Premezclas de vitaminas para proporcionar/kg de alimento: Vitamina A 4000 UI, vitamina D3 2200 UI, niacina 88 mg, ácido D-pantoténico 35 mg, vitamina B12 0.009 mg, vitamina E 55 UI, riboflavina 13 mg, cloruro de colina 550 mg, menadione complejo bisulfato sódico 10 mg, piridoxina HC 10 mg, tiamina mononitrato 10 mg, ácido fólico 2 mg, etoxiquín (antioxidante) 138 mg, ácido ascórbico 178.5 mg.
⁴ Premezcla de vitaminas para proporcionar/kg de alimento: Vitamina A 4400 UI, vitamina D3 2200 UI, vitamina E 55 UI, vitamina K 11mg, tiamina 11 mg, riboflavina 13.2 mg, piridoxina 11 mg, ácido pantoténico 35.2 mg, ácido nicotínico 88 mg, ácido fólico 2.2 mg, vitamina B12 0.09 mg, cloruro de colina (70 %) 550 mg.
⁴ Premezcla de minerales traza para proporcionar/kg de alimento: Manganeso 86.5 mg, yodo 1 mg, cobre 4 mg, zinc 66.5 mg, fierro 33 mg, cobalto 0.7 mg.
⁵ Premezcla de minerales traza para proporcionar/kg de alimento al nivel de 0.05 %: Zinc 150 mg, manganeso 25 mg, cobre 4 mg, fierro 20 mg, yodo 1.5 mg y selenio 0.1 mg.
⁶ Revestido con eticelulosa.
Fuente: Winfree y Stickney (1984) - Dietas 1, 2 y 3; Robinett (1984) - Dietas 4, 6 y 7; Mgbenka y Lovell (1984) - Dieta 5; Dietas 5, 6 y 7 son formulaciones para alimentos expandidos.
12. Carpa común (Cyprinus carpio) - dieta seca, peletizada

¹ El rendimiento en el crecimiento de los peces en la dieta 2 puede ser incrementado hasta el crecimiento en la dieta 1 por la aspersión de 5 % de aceite (aceite de la industria avícola o residuos acidulados de soya para la fabricación de jabón) sobre el pellet.
² Contenido constante por kg de los pellets: Vitamina A 8000 UI, vitamina D 900 UI, vitamina E 2 UI, vitamina K 4 mg, riboflavina 3.6 mg, niacina 20 mg, cloruro de colina 160 mg, ácido pantoténico 7 mg, piridoxina 0.2 mg, vitamina B12 5 g, Mn 70 mg, Zn 60 mg, Fe 20 mg, Cu 2 mg, I 1 mg, Co 0.2 mg, ingredientes variables: bentonita, fosfato dicálcico (nota: la premezcla empleada es esencialmente una premezcla vitamínica para aves de corral).
Fuente: Viola et al., (1982).
13. Camarón Kuruma (Penaeus japonicus) - Dieta seca, pellet

¹ La levadura de ácido láctico se obtuvo de cambios de lactosa bajo la acción de Kluyveromyces lactis y fragilis (Saccharomyces).
² La premezcla de vitaminas proporciona % de mg de la dieta: Tiamina hidroclorada 5 mg, riboflavina 40 mg hidroclorada 10 mg, vitamina B12 0.01 mg, ácido nicotínico 75 mg, pantotenato de calcio 50 mg, biotina 1 mg, inositol 200 mg, ácido fólico 3 mg, cloruro de colina 250 mg, ácido paraminobenzoico 40 mg, vitamina K 2.5 mg, vitamina E 25 mg, vitamina C (sal de Ca) 500 mg, vitamina 4000 UI, vitamina D3 250 UI, colesterol 1250 mg.
³ Premezcla vitamínica protegida: contenido de vitaminas/kg dieta 3 - vitamina A 46,165 UI, vitamina D3 12,000 UI, vitamina E 74 mg, vitamina C 3,089 mg, tiamina 29.5 mg, riboflavina 55 mg, piridoxina 14 mg, pantotenato de calcio 100 mg, vitamina PP (niacina) 120 mg, vitamina H (biotina) 450 mg, inositol 4,000 mg, clorhidrato de colina 3, 368 mg (de los análisis químicos de la dieta de Cuzon et al., 1982).
⁶ KHPO4 10%, Ca3(PO4)2 15%, lactato de calcio 75 %.
Fuente: Deshimaru y Shigeno (1972) - Dieta 1; Cuzon, et al., (1981) - Dieta 2, Cuzon et al., (1982) - Dieta 3.
14. Camarón Tigre Gigante (P. monodon) - Dieta seca, pellet

¹ Asignación proporcionada de vitaminas por la destrucción de las vitaminas lábiles al calor durante la preparación de las dietas (por vapor y calor seco). Composición de vitaminas/minerales/kg de premezcla: Vitamina A 1'760,000 unidades USP, vitamina D3 660,000 unidades USP, vitamina E 770 UI, vitamina K 120 mg, tiamina 440 mg, vitamina B12 4400 ug, niacina 6000 mg, pantotenato de calcio 1200 mg, cloruro de colina 44,000 mg, ácido fólico 22 mg, FeSO4, 8800 mg, KI 440 mg, CaCO3/PO4/SO4 120,000 mg, CoSO4 44 mg, CuSO4 440 mg, MgSO4 6600 mg, KSO4 66 mg, ZnSO4 17,600 mg, MnSO4 12,000 mg, L-lisina hidroclorada 6600 mg, metionina 8800 mg, (V-22 es una premezcla de vitaminas-minerales para aves de corral).
² Para proporcionar/Kg de dieta seca: Tiamina 30 mg, riboflavina 80 mg, piridoxina 40 mg, vitamina B12 0.1 mg, niacina 400 mg, ácido pantoténico 200 mg, biotina 2 mg, inositol 600 mg, ácido fólico 10 mg, cloruro de colina 5000 mg, ácido paraminobenzoico 150 mg, ácido ascórbico 500 mg, vitamina A (20,000 UI) 40, vitamina D3 10 mg, vitamina E 150 mg, vitamina K 30 mg, BHT 10 mg, finalmente maíz molido 2747.9 g.
³ Para proporcionar/Kg de dieta seca: K2HPO4 1 g, NaH2PO4 2.15 g, Ca(H2PO4)4.H2) 2.65 g, CaCO3 1.05 g, lactato de calcio 1.65 g, KCL 0.28 g, MgSO4.7H2O 1.0 g, citrato férrico 0.12 g, AlCl3.6H2O 0.0024 g, ZnSO4.7H2O 0.0476 g, MnSO4.6H2O 0.0107 g, CuCl 0.0015 g, KI 0.0023 g, CaCL3.6H2O 0.0140 g, finalmente harina de maíz molida 0.0215 g.
Fuente: Vogt, Quinitio y Pascual (1986) - Dieta 1 y 2; Pascual (1983) - Dieta 3: Lim y Destajo (1979) - 4.
15. Camarón Tigre Gigante (P. monodon) - Dieta seca, pellets

¹ No. 1 premezcla vitamínica protegida que provee/kg de dieta: Vitamina A 80,000 UI, vitamina D3 8,000 UI, vitamina E 150 mg, vitamina K 8 mg, vitamina C 600 mg, tiamina 18 mg, riboflavina 16 mg, niacina 400 mg, pantotenato de calcio 200 mg, piridoxina hidroclorada 16 mg, ácido fólico 17 mg, vitamina B12 0.04 mg, biotina 0.02 mg, cloruro de colina 1500 mg, inositol 800 mg, ácido para-amino benzoico 60 mg (premezcla usada por AQUACOP, 1978, para Penaeus merguienses; composición de la premezcla usada en la presente formulación no citada)
² Suplementos de premezclas/kg de dieta: Tiamina hidroclorada 120 mg, riboflavina 40 mg, piridoxina hidroclorada 120 mg, ácido nicotínico 150 mg, pantotenato de calcio 100 mg, ácido fólico 5 mg, biotina 1 mg, vitamina B12 0.02 mg, inositol 400 mg, cloruro de colina 1200 mg, ascorbato de sodio 5000 mg, alfa-tocoferol 200 mg, menadiona 40 mg, vitamina A 5000 UI, vitamina D3 1000 UI, Zn 40 mg, Mn 20 mg, Cu 4 mg, I 0.8 mg, Co 0.12 mg.
³ El autor cita que el gluten de trigo puede ser un mejor agente aglutinante; Kanazawa (1984)
Fuente: AQUACOP (1983) - Dieta 1 y 3; Kanazawa (1984) - Dieta 3 (también utilizada como alimento o dieta completa para Penaeus merguiensis, (AQUACOP (1977).
16. Camarón (P. californiensis) - Dieta seca, granulado
¹ Para suplementar/kg de alimento terminado: Vitamina A 201,000 UI, vitamina D3 2000UI, vitamina E 19.4 UI, menadiona SBC 50 mg, mononitrato de tiamina 30 mg, riboflavina 2.7 mg, niacina 18 mg, piridoxina hidroclorada 30 mg, ácido D-pantoténico 90 mg, ácido Fólico 50 mg, vitamina B12 0.5 mg, biotina 50 mg, inositol 1100 mg, ácido ascórbico 1000 mg.
² Dieta molida en una mezcla aglutinada en una solución de agua dulce o ácido algínico, la reacción empieza a regularse por la adición de 1 % de hexametafosfato de sodio.
Fuente: Brand y Colvin (1977).
Dietas de prueba experimentales purificadas y completas - Peces y camarones
18. Dietas de referencia estándar para peces

17. Camarón gigante de río (Macrobrachium rosenbergii) - Dieta seca, pellets

¹ Contenido de la premezcla mineral: K2PO4 30 %, KCl 9.4%, MgSO4 14.8%, CaHPO4.2h2O 27.4 %, FeCl3 1.4%, MnSO4.7H2O 0.2%, CaCO3 16.8%.
² Composición de premezcla de vitaminas: Vitamina A 2'750,000 UI, vitamina D3 550,000 UI, vitamina E 25,000 UI, vitamina K3 5000 mg, colina 250,000 mg, niacina 50,000 mg, riboflavina 10,000 mg, piridoxina 10,000 mg, tiamina 10,000 mg, pantotenato de calcio 25,000 mg, biotina 50 mg, folacin 2500 mg, vitamina B12 10 mg, ácido ascórbico 50,000 mg (la dosis por tonelada de alimento es 2 kg 0.2%, la premezcla esta basada en los requerimientos de peces de aguas dulces cálidas de la NRC (1983).
³ No se dan detalles de la composición.
Fuente: Thong (1985) - Dieta 1; Nanik (1976) - Dieta 2 o 3; Boonyaratpalin y New (1982) - Dieta 4.
19. Camarón/dietas de referencia estándar para crustáceos

¹ Preparada como una mezcla húmeda por la adición de 3g de agar y 130 ml de agua/100 g de dieta seca.
² La dieta seca contiene 38.1 % de proteína cruda, 10.5 % de lípidos y 6.5 % de cenizas (en base de peso seco).
³ La dieta seca contiene 38.8 % de proteína cruda, 12.9 % de lípidos y 3.7 % de cenizas (en base de peso seco).
⁴ La premezcla vitamínica proporciona mg/100 g de dieta seca: Acido paraminobenzoico 10 mg, biotina 0.4 mg, inositol 400 mg, ácido nicotínico 40 mg, pantotenato de calcio 60 mg, piridoxina hidroclorada 12 mg, riboflavina 8 mg, tiamina hidroclorada 4 mg, menadiona 4 mg, beta caroteno 9.6 mg, alfa-tocoferol 20 mg, vitamina B12 0.08 mg, vitamina D3 1.2 mg, ascorbato de sodio 2000 mg, ácido Fólico 0.8 mg, cloruro de colina 120 mg.
⁵ Composición de premezcla vitamínica (%): Tiamina hidroclorada 0.32 %, riboflavina 0.72 %, niacinamida 2.6 %, D-biotina 0.008 %, pantotenato de calcio 1.43 %, piridoxina hidroclorada 0.24 %, ácido fólico 0.097 %, menadiona 0.08 %, vitamina B12 0.27 %, inositol 12.7 %, vitamina D3 (850,000 UI/g) 0.002 %, acetato de vitamina A (500,000 UI/g) 0.52 %, ácido ascórbico 6.1 %, BHA 0.076 %, BHT 0.076 %, ácido paraminobenzoico 2.02 %, celufil 72.77 %.
⁶ Composición de la premezcla vitamínica (%): Tiamina hidroclorada 0.5 %, riboflavina 0.8 %, niacinamida 2.6 %, D-biotina 0.1 %, pantotenato calcio 1.5 %, piridoxina hidroclorada 0.3 %, ácido fólico 0.5 %, vitamina B12 0.1 %, inositol 18.1 %, ácido ascórbico 12.1 %, BHA 0.1 %, ácido paraminobenzoico 3 %, celufil 60.3 %.
⁷ La mezcla mineral proporciona g/100 g de dieta seca: K2HPO4 2 g, Ca3(PO4)2 2.72 g, MgSO4.7H2O 3.04 g, NaH2PO4.2H2O 0.79 g, NaH2PO4.2H2O 0.79 g.
⁸ Mezcla de sales modificada de Bernhart-Tomarelli
Fuente: Kanazawa, Teshima y Tokiwa (1977) - Dietas de prueba semipurificadas para camarones peneidos. Castell (1986) - proteína de cangrejos y la referencia de las dietas para crustáceos de Bodega Bay.
¹ Preparación de la dieta: Disuelva la gelatina en agua fría: caliente con agitación en un baño de agua caliente a 80° C. Quítelo del calor. Añada con agitación - dextrina, caseína, minerales, aceites y vitaminas hasta que la temperatura se reduzca. Mezcle bien a 40 C. Vierta en los recipientes; sáquelos del refrigerador hasta que estén endurecidos. Quítelos de las charolas y almacénelos en recipientes sellados en el refrigerador hasta que sean usados, la consistencia de la dieta se ajusta se ajusta con la cantidad de agua en la mezcla final y la longitud y la fuerza del batido.
² Ajustar nivel de proteína y lípidos si es necesario (según la especie de pez) peletizado a vapor, 5–10psi sin agua.
³ Aceite de origen marino con 0.05 % de antioxidante (u otros aceites de acuerdo a requerimientos).
⁴ Los suplementos incluyen 0.5 % de metionina, 1 % de arginina y 0.5 % de almidón.
⁵ La mezcla de vitaminas proporciona/kg de dieta seca: Alfa celulosa 80 g (como relleno; elimine 20 g de celulosa y adicione 20 g de aglutinante de carboximetilcelulosa para la alimentación preliminar), cloruro de colina 5 g, inositol 2 g, ácido L-ascórbico 1 g, ácido nicotínico 750 mg, pantotenato de calcio 500 mg, riboflavina 200 mg, tiamina hidroclorada 50 mg, piridoxina hidroclorada 50 mg, menadiona 40 mg, ácido fólico 15 mg, vitamina B12 11 mg (adicione vitamina B12 durante la mezcla final), biotina 5 mg, acetato de alfatocoferol 400 mg (disuelva tocoferol en la mezcla del aceite).
6 La mezcla de vitaminas proporciona/kg de dieta seca: Acetato de vitamina A 7000 UI, vitamina D3 3000 UI, vitamina E 200 UI, vitaminaK 50 mg, tiamina hidroclorada 40 mg, riboflavina 60 mg, pantotenato D-cálcico 200 mg, biotina 0.5 mg, ácido fólico 20 mg, vitamina B120.2 mg, niacina 300 mg, piridoxina hidroclorada 40 mg, inositol 500 mg, ácido ascórbico 500 mg, citrato de colina 6000 mg, alfacelulosa o almidón en suficiente cantidad para dar un total de premezcla de 30 g.
7 La mezcla de vitaminas podría reunir o exceder los niveles presentados por NRC (1983) y ser suficiente para cubrir las pérdidas en el procesamiento y almacenaje.
8 La mezcla de minerales contiene/100 g de premezcla: Bifosfato cálcico 13.58 g, lactato cálcico 32.70 g, citrato férrico 2.97 g, sulfato de magnesio 13.20 g, fosfato de potasio (dibásico) 23.98 g, bifosfato sódico 8.72 g, cloruro de sodio 4.35 g, AlCl3.6H2o 0.015 g, ZnSO4.H2O 0.30 g, CuCl 0.01 g, MnSO4.H2O 0.08 g, KI 0.015 g, CoCl2.6H2O 0.10 g.
9 La mezcla de minerales ofrece/kg en dieta seca: CaHPO4.2H2O 30 g, CaCO3 3 g, NaCl 15 g, K2SO4 20 g, MgSO4 10 g, FeSO4.7H2O 700 mg, MnSO4.H2O 300 mg, ZnSO4.H2O 550 mg, CuSO4.5H2O 160 mg, CoCl2.6H2O 26 mg, KI 15 mg, Na2SeO3 2.5 mg, alfacelulosa o almidón adicionado en cantidades suficientes para completar un total de premezcla de 80 g.
10 Mezcla de minerales de Williams y Briggs (1963) suplementada con cloruro de cobalto (1 mg/kg de dieta), sulfato potásico y de aluminio (0.7 mg/kg de dieta) y selentia de sodio (0.05 mg/kg de dieta); NRC (1983).
Fuente: Castell y Tiews (1980) - H440 Referencias de dietas estándar las cuales se han generado satisfactoriamente pare el uso en salmónidos, char, bagre, carpa, brema marina, perca, huachinango, pámpano, mero, bacalao y lobina negros. Cho, Cowey y Watanabe (1985) - C102 Dieta de prueba. NRC (1983) - 36 % de proteína cruda en la dieta que contiene 2.9 kcal de energía digerible/g; dietas de prueba semipurificada para peces de aguas cálidas.
2.3 Almacenaje y manufactura de dietas completas peletizadas
2.3.1 Antecedentes
La manufactura de alimentos implica la transformación física de una fórmula escrita en un compuesto “comestible” o dieta. Existe una amplia variedad de técnicas para la elaboración de dietas completas en acuacultura, comenzando desde el mezclado/licuado (alimento amasado seco; alimento amasado, en bolas, pasta o granulado semihúmedo/húmedo compactado a mano: New 1987), hojueleado (dietas para larvas en hojuelas: Meyers y Hagood, 1984), procesadas (alimentos granulados o peletizados sin compactar, semihúmedos o secos: Pigott, 1980), pellet compactado en húmedo (pellets semihúmedos o húmedos: AQUACOP, 1978; New, 1987), pellets compactados a vapor o secos (pellets secos: Csavas, Majoros y Varadi, 1979; Robinson, 1976; Hastings y Higgs, 1980, New, 1987), peletizado por extrusión/expansión (pellets secos, húmedos o expandidos rehidratables: Smith, 1976; Williams, 1986; Melcion et al., 1983, Hilton, Cho y Slinger, 1981; Vens-Cappell, 1984; Werner y Pfleiderer, Struttgart, República Federal de Alemania - Literatura de ventas: cocido por extrusión para mejorar los alimentos de camarón), hasta la microencapsulación (dietas microencapsuladas para larvas, secas y rehidratables: Nixon, 1976; Jones y Gabbot, 1976; Chow, 1980; Meyer, Butler y Sirine, 1971; Jones, 1984; Scura, Fischer y Yunker, 1984).
La selección de los procesos de manufactura a ser empleados, dependerá de los hábitos alimenticios de los peces o camarones a ser alimentados (i.e. comedores del bentos, pelágicos o de superficie; comedor visual u olfatorio; comedor de dietas secas o húmedas; comedores rápidos o lentos) y de los requerimientos físicos del alimento (i.e. tamaño del alimento, flotabilidad, textura, palatabilidad y estabilidad deseada en el agua) para todos los estados del ciclo de cultivo. Estos factores técnicos en cambio, tendrán que ser balanceados entre el valor de mercado de las especies en cultivo y la disponibilidad de los recursos económicos, ingredientes alimenticios y servicios. No es la intención en este manual describir mecánicamente cada uno de los procesos de manufactura mencionados anteriormente (las técnicas están bien establecidas y los lectores deberán obtener esta información consultando las revisiones individuales mencionadas arriba; para una revisión general vea ADCP, 1980 y New, 1987), pero si puntualizar algunos de los problemas que son únicos en la fabricación de dietas peletizadas completas para acuacultura.
2.3.2 Molido
La eficiencia de un proceso de manufactura de alimentos y la eficiencia biológica de una dieta en el compuesto dependerá fundamentalmente del molido inicial, y consecuentemente del tamaño de partícula de los materiales básicos crudos utilizados. La ventaja del molido es doble: para el nutricionista, facilita la destrucción de los factores antinutricionales termolábiles invariablemente presentes y mejora la digestibilidad de los nutrientes al incrementar el área superficial de las partículas alimenticias; para los animales, un alimento compuesto molido mejora la aceptabilidad por el alimento y la peletización (este prolonga la vida de los dados, facilita la penetración del vapor dentro de las partículas de alimento e incrementa la eficiencia de caballaje), mejora las propiedades de mezcla de cada uno de los ingredientes individuales y también se incrementa la densidad del material del ingrediente alimenticio (Tacon y Jackson, 1985). Sin embargo, en contraste con la industria para manufactura intensiva de alimentos para ganado y animales de corral, donde los ingredientes han sido molidos a un tamaño de partícula por debajo de 1 mm, la manufactura de un pellet de buena calidad adecuado para acuacultura, requiere que todos los ingredientes sean primero molidos para pasar a través de una malla de 0.25mm (para premezclas y granulados de iniciación) y de mallas de 0.35 mm (para pellets para reproductores o de crecimiento) de tal manera que tenga el tamaño físico requerido por el animal cultivado y para obtener los máximos beneficios nutricionales de cada uno de los nutrientes presentes. Además, para el crecimiento de las fases larvarias tempranas de muchas especies de peces marinos y de camarón, la preparación de dietas completas microencapsuladas o microparticuladas requieren del uso de ingredientes finamente molidos, los cuales pueden variar en tamaños de 10 a 500μ (Kanazawa et al., 1982a).
De hecho, uno de los mayores problemas encontrados en la manufactura de alimentos peletizados para acuacultura dentro de los países en desarrollo, es que son producidos invariablemente en molinos de alimentos diseñados y equipados específicamente para la manufactura de alimentos para ganado y animales de corral, y como tales, no tienen la capacidad necesaria para el molido fino ni el procesamiento total de los materiales que son utilizados, para justificar la compra de tal equipo. No es necesario mencionar que los costos del molido fino, en términos de equipo y consumo de energía, son elevados (para una revisión vea Pfost, 1976, Hastings y Higgs, 1980 y New, 1987).
2.3.3 Peletizado
El sistema de compactación o peletizado a vapor es de hecho la técnica más común de producción empleada para la manufactura comercial de alimentos para acuacultura (para una revisión vea Robinson, 1976; Csavas, Majoras y Varadi, 1979; Hastings y Higgs, 1980 y New, 1987). Sin embargo, aparte de los beneficios generalmente reconocidos a los sistemas convencionales de compactación de pellets secos o a vapor (Figura 2; Heinemans, 1986), los desarrollos más recientes y la aplicación de las técnicas de peletizado por extrusión 1, como por ejemplo la expansión, han ofrecido algunos horizontes nuevos para los fabricantes de alimentos para acuacultura. Las ventajas del peletizado por extrusión sobre los sistemas convencionales de peletizado a vapor se pueden resumir como sigue:
-
Las altas temperaturas empleadas durante el cocido por extrusión facilitan la ruptura de las membranas de celulosa que rodean a las células vegetales y a los gránulos individuales de almidón de los cereales y las oleaginosas, con la consecuente gelatinización del almidón y el incremento de la biodisponibilidad calorífica de los carbohidratos (Smith, 1976; Hilton y Slinger, 1983; Vens-Cappell, 1984).
-
Las altas temperaturas empleadas durante la extrusión facilitan la inactivación y/o destrucción de factores antinutricionales termolábiles que se encuentran normalmente presentes en los cereales y oleaginosas (i.e. inhibidores enzimáticos del crecimiento) y contaminantes exógenos dentro de los subproductos animales (i.e. Salmonella: Smith, 1976; Horn, 1979; Tacon y Jackson, 1985).
-
El cocido por extrusión produce pellets que son extremadamente estables en estado seco y entonces se pueden almacenar por largos períodos de tiempo sin degradación de los nutrientes (R.J. McDonald, Wenger International, Kansas City, USA Comunicación Personal, Noviembre, 1985).
¹ El peletizado por expansión o extrusión es un proceso de calentamiento húmedo, por medio del cual los ingredientes premolidos y mezclados secos son primero acondicionados con vapor y/o agua a presión atmosférica (la mezcla de alimentos en esta etapa contendrá 20–30 % de humedad; temperatura de acondicionamiento 65–95°C) y luego son llevados a un barril de extrusión presurizado (conocido como extrusor) en donde la mezcla de alimento es cocida a una temperatura de 130–180°C por medio de calor y presión mecánica por 10–60 segundos (el período de cocimiento y la temperatura dependen del tamaño de partícula de los ingredientes, de la composición de la mezcla del alimento y de las propiedades físicas requeridas de la dieta extruida). La harina cocida es entonces extruida por medio de un tornillo ahusado, pasando a través de un dado al final del barril de extrusión presurizado hacia el exterior, donde el material se expande y es cortado a la longitud o forma física deseados. Durante este proceso, el alimento cocido y extruido emerge del dado con una densidad más baja y con un contenido de humedad de 25–30 %, el cual requiere de un secado posterior. El proceso de extrusión requiere de una cierta cantidad de carbohidratos presentes en la mezcla (como almidón); el almidón gelatinizado se vuelve plástico, absorbe agua y en el sobrecalentamiento se vaporiza produciendo la expansión consecuente. Un diagrama de flujo típico para una fábrica de alimentos que utiliza un sistema de cocido y extrusión se muestra en la Figura 3.

Figura 2. Ventajas del peletizado (Fuente: California Pellet Mill Pelleting Handbook - ningún dato dado)

Figura 3. Un diagrama de flujo típico de una planta para fabricación de alimentos animales utilizando un sistema de cocido por extrusión (Fuente: Horn, 1979; Wiliams, 1986)
-
La alta durabilidad mecánica de los pellets extruidos (obtenida por la gelatinización del almidón y una fuerte aglutinación intermolecular) resulta en una baja producción de finos durante el manejo, transporte y alimentación, lo que asegura un consumo máximo de alimentos y minimiza la contaminación del agua (debida a la descomposición potencial de los finos no consumidos dentro del cuerpo de agua en el que se cultivan los peces o camarones; R. J. McDonald - Comunicación personal, noviembre, 1985).
-
En contraste a la mayoría de los alimentos peletizados a vapor, los pellets extruidos son extremadamente estables en agua
y pueden mantener su integridad física por períodos prolongados, permitiendo que más alimento sea consumido mientras se mantiene la calidad del agua; por lo tanto los alimentos extruidos son ideales para aquellas especies en acuacultura con hábitos alimenticios lentos como los camarones marinos (Meyers, 1979; Hilton, Cho y Slinger, 1981; Melcion et al., 1983).
-
La alta durabilidad mecánica de los pellets extruidos (obtenida por la gelatinización del almidón y una fuerte aglutinación intermolecular) resulta en una baja producción de finos durante el manejo, transporte y alimentación, lo que asegura un consumo máximo de alimentos y minimiza la contaminación del agua (debida a la descomposición potencial de los finos no consumidos dentro del cuerpo de agua en el que se cultivan los peces o camarones; R. J. McDonald - Comunicación personal, noviembre, 1985).
-
En contraste a la mayoría de los alimentos peletizados a vapor, los pellets extruidos son extremadamente estables en agua y pueden mantener su integridad física por períodos prolongados, permitiendo que más alimento sea consumido mientras se mantiene la calidad del agua; por lo tanto los alimentos extruidos son ideales para aquellas especies en acuacultura con hábitos alimenticios lentos como los camarones marinos (Meyers, 1979; Hilton, Cho y Slinger, 1981; Melcion et al., 1983).
-
El cocimiento por extrusión ofrece al fabricante la flexibilidad de producir alimentos estables en el agua, diseñados según los requerimientos físicos de alimentación de las especies cultivadas (i.e. en términos de textura de alimentos, palatabilidad, flotabilidad, forma y color). Por ejemplo, debido a su bajo volumen y naturaleza porosa, los alimentos expandidos se pueden rehidratar con 200–300% de agua (sola o con estimulantes alimenticios disueltos) antes de alimentar a los animales, de manera que se produzca un alimento extruido húmedo o suave (Melcion et al., 1983; Metailler, Cadena- Roa y Person-Le Ruyet, 1983), y/o recubiertos con lípidos (solos o mezclados con premezclas de vitaminas/fosfolípidos/ pigmentos) para producir dietas protegidas con altos niveles de lípidos o vitaminas (mediante un baño de lípidos o emulsificación) con una gran estabilidad en el agua y características de baja disolución de nutrientes (Melcion, et al., 1983; Metailler, Cadena-Roa y Person-Le Ruyet, 1983). Además, a través de una formulación cuidadosa y controlando la gelatinización del almidón en el barril extrusor, es posible producir alimentos con diferentes densidades y consecuentemente con diversas propiedades de flotación o de rápido hundimiento (Smith,1976; Williams, 1986). Los alimentos flotantes son ideales para sistemas de cultivo en jaulas, donde las pérdidas por alimentación se pueden mantener a un mínimo y se puede verificar visualmente el consumo del alimento (Hilton, Cho y Slinger, 1981; Vens-Cappell, 1984).
Se pueden mencionar, sin embargo, algunos aspectos negativos del peletizado por extrusión, ya que éste es más caro que un sistema regular de peletizado por vapor (en términos de equipo así como de costos de energía para operación, incluyendo los costos adicionales por secado del alimento extruido) y puede provocar la pérdida o dañar los nutrientes sensibles al calor (i.e. como el ácido ascórbico, tiamina, ácidos grasos polinsaturados y la lisina) si la cocción no está adecuadamente controlada (Horn, 1979; Slinger, Razzaque y Cho, 1979; Hilton, Cho y Slinger, 1981; Hilton y Slinger, 1983; Melcion et al., 1983; Vens-Cappell, 1984). Más que fortificar la mezcla alimenticia antes de entrar al proceso de extrusión, los aditivos sensibles al calor (i.e. lípidos marinos, vitaminas, antioxidantes, emulsificantes y pigmentos) se pueden aspersar sobre los pellets expandidos después de la extrusión (Hastings y Higgs, 1980).
Además, desde el punto de vista de los altos requerimientos de carbohidratos (c. 15–25 % en la dieta) para una adecuada extrusión, se debe tener cuidado cuando se fijan los niveles dietéticos de carbohidratos en las formulaciones para especies carnívoras de camarones y peces, los cuales tienen una baja tolerancia a los carbohidratos digeribles (Hilton, Cho y Slinger, 1981; Hilton y Slinger, 1983). En la Tabla 5 se muestran algunas fórmulas de raciones extruidas (formulaciones No. 6 y 11).
2.3.4 Almacenaje
En la fabricación de una dieta se llega inevitablemente a un período de almacenaje, tanto en la fábrica para los alimentos terminados o en los almacenes de la granja, antes de la alimentación. Dado que los alimentos están compuestos de nutrientes lábiles, esto implica que el período de almacenamiento debe ser corto y que se deben de proporcionar las condiciones de almacenaje adecuadas, para prevenir los cambios deteriorativas que ocurren en la composición de los nutrientes a través del daño oxidativo y/o a través de la infestación con microbios, insectos o roedores.
Previamente se han discutido los efectos deletéreos de un almacenaje prolongado en la estabilidad de vitaminas y lípidos (Tacon, 1987; Sección 3.7.4 y 5.5.1), y aquí solo nos referiremos a relaciones establecidas entre las condiciones ambientales de almacenaje y la infestación de plagas.
Los factores ambientales más importantes que gobiernan el tiempo de almacenaje o la vida de estantería en un alimento terminado son la temperatura y la humedad; estos factores dictan la tasa en la cual se realizan los cambios químicos, el incremento en el contenido de humedad de los productos almacenados, y el crecimiento de organismos contaminantes tales como hongos, bacterias, e insectos. dentro del alimento.
Por ejemplo, en las Figuras 4/5 y en la Tabla 6 se muestra la relación entre la temperatura ambiental y la humedad relativa sobre la infestación de hongos/plagas y el contenido de humedad de los alimentos e ingredientes almacenados, respectivamente.
Tabla 6. Efectos de la humedad relativa del almacenaje sobre la humedad de los alimentos

De hecho, una de las plagas más importantes de alimentos almacenados en climas cálidos y húmedos, son las infestaciones microbianas con hongos filamentosos o mohos; los mohos normalmente son activos solamente a altas humedades relativas, por arriba de 70 %, y su actividad generalmente empieza a ser alta a temperaturas elevadas, cerca de 35 a 40°C (Cockerell, Francis y Halliday, 1971). En contraste, las infestaciones bacterianas ocurren generalmente en alimentos almacenados que tienen un contenido de humedad que excede el 25 % (equivalente a una humedad relativa arriba del 90 %). Los hongos más comunes involucrados en el deterioro de alimentos incluyen a Aspergillus, Cladosporium, Penicillium y Helminthosporioum (Figura 5). Las consecuencias del crecimiento de mohos en el deterioro alimentos almacenados se pueden resumir como sigue:
-
Reducción del valor nutricional de los alimentos almacenados: el crecimiento de los mohos resulta en la pérdida de lípidos (a través de la destrucción o digestión enzimática), aminoácidos (los más afectados son la lisina y la arginina) y vitaminas (Jones, 1987). Por ejemplo, de acuerdo con Jones (1987), las pérdidas estimadas en energía metabolizable en maíz debido a hongos varía de 5 a 25 %, dependiendo de las especies de mohos implicadas. En adición, los hongos favorecen el desarrollo de rancidez cetónica de los lípidos y el obscurecimiento no enzimático (Cockerell, Francis y Halliday, 1971).

Figura 4. Relaciones entre la temperatura ambiente y el contenido de humedad en el alimento y el riesgo de infestación con plagas en alimentos almacenados (Fuente: Zuercher, 1987).
-
Se afecta adversamente el sabor y la apariencia: el crecimiento de mohos puede causar que los alimentos se agrupen en forma de grumos o pelotas, que cambie la consistencia el color y el sabor, y en general ser menos apetecible (Cockerell, Francis y Halliday, 1971; Chow, 1980a; Jones, 1987).
-
Producción de Micotoxinas: Ciertas especies de mohos, y en particular Aspergillus flavus, producen metabolitos tóxicos o micotoxinas, de las cuales la aflatoxina Β1 es la más tóxica, provocando cáncer (tumores) y daños en el hígado en casi cualquier especie animal, incluyendo los peces (Chow, 1980a; NRC, 1983; Lovell, 1984). A la fecha, se han identificado cerca de 200 micotoxinas, cada una exhibiendo una toxicidad y sintomatología específicas entre los animales que las ingieren (Jones, 1987). Entre los productos alimenticios que son especialmente susceptibles al ataque de A. flavus se incluyen el maní, la semilla de algodón y la copra y en menos grado, el maíz, sorgo, girasol, la soya y la yuca o casava (Chow, 1980). Con una estabilidad relativamente alta en la mayoría de los alimentos, la aflatoxina β1 no se puede destruir con seguridad por cocimiento (Liener, 1980). Muchos países han impuesto estrictos estándares de seguridad para los productos de maní, incluyendo la prohibición de importar alimentos para ganado con contenidos de maní, en los cuales los niveles de aflatoxina Β1, excedan 0.05 mg/kg.
-
Finalmente, pero no menores en importancia, los insectos también pueden causar daños considerables a los alimentos almacenados, ya sea a través del consumo directo de los alimentos, su contaminación (con excrementos, telarañas, partes del cuerpo, olores indeseables y bacterias patógenas-Salmonella), o indirectamente, produciendo calor e incrementando el contenido de humedad de los alimentos y con ello, proporcionando condiciones favorables para el crecimiento de los mohos (Cockerell, Francis y Halliday, 1971; Chow, 1980a; Zuercher, 1987).
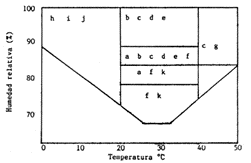
Figura 5. Temperaturas y humedades relativas en las que las especies de hongos comúnmente presentes en alimentos almacenados pueden ser más importantes: a) Aspergillus candidus; b) A. flavus; c) A. fumigatus; d) A. tamarii; e) A. niger; f) A. glaucus; g) A. terreus; h) Penicillium cyclopium; i) P. martensii; j) Cladosporium spp; k) Sporendonema sebi (Fuente: Cockerell, Francis y Halliday, 1971)
Los requerimientos básicos para un buen almacenaje de alimentos son aquellos que deben dar protección en contra de altas temperaturas, humedad, insectos y roedores. Un error común en el diseño de los almacenes es la falta de un piso adecuado. Este, al igual que las paredes, debe de estar impermeabilizado adecuadamente, mientras que las bolsas que contienen alimentos deberán ser almacenadas sobre tarimas de madera. En forma ideal, los alimentos húmedos y semihúmedos utilizados en acuicultura, se deben almacenar bajo refrigeración o usarse el mismo día de su preparación para evitar pérdidas vitamínicas (Tacon, 1987; sección 5.5.1). En forma similar, los alimentos peletizados secos se deben almacenar en condiciones limpias y bien ventiladas, evitando altas temperaturas e insolación directa, debiendo ser utilizados durante los dos primeros meses de su manufactura. En forma práctica, sin embargo, los períodos de almacenamiento variarán de algunas horas hasta un máximo de seis meses, dependiendo de la disponibilidad de los alimentos, de la orden mínima de alimento de la fábrica, del tamaño de la granja y del estatus financiero del granjero. Para una revisión de los conservadores químicos que se pueden usar para combatir el crecimiento de mohos y daños oxidativos en los alimentos, vea la tabla 5 (formulaciones No. 4, 5, 10, 11, 17 y 19) y Tacon (1987a; sección 4.1). Guías para un adecuado almacenaje de alimentos son dadas por Chow (1980a) y New (1987).
2.4.1 Alimentación de larvas de peces marinos¹
En esta revisión se hará un énfasis sobre las dietas completas para larvas y los métodos de alimentación empleados en forma corriente para una propagación masiva de especies de peces y camarones marinos; la mayoría de ellos tienen huevos flotantes pequeños (< 1.5 mm de diámetro), con pobres reservas en el saco vitelino y que en la eclosión producen pequeñas larvas plantónicas muy vulnerables (0.3 - < 5 mm de longitud corporal: Blaxter, 1969). La alimentación de larvas de peces de agua dulce (las cuales tienden a tener un tamaño mayor que las de sus contrapartes marinas o de aguas salobres) no será tratada aquí, ya que éstas especies usualmente se producen a través de métodos de alimentación semi intensiva en estanques de incubación.
De acuerdo con Kuronuma y Fukusho (1984) los principios que guían la alimentación de larvas en estanques o encierros son:
-
Que el alimento proporcionado sea consumido completamente
-
Que el alimento sea bien digerido, manteniendo al animal saludable y creciendo normalmente, y,
-
Que la producción y disponibilidad de este tipo de alimentos sea económicamente factible.
¹ Las larvas se refieren al período entre la eclosión (individuos con saco vitelino) y las crías de peces o camarones en su estado de postlarva (cuando los individuos han completado la metamorfosis y toman la apariencia de un subadulto).
Basándose en los criterios anteriores, normalmente están disponibles cuatro estrategias de alimentación larvaria o de “criadero”, para la propagación masiva de larvas de peces y camarones marinos, durante la metamorfosis hasta las postlarvas o estados libres. Estas incluyen:
-
El uso exclusivo de una sucesión de organismos vivos del plancton (i.e. algas, diatomeas, flagelados, levaduras, rotíferos, copépodos, nauplios y metanauplios de Artemia salina).
-
El uso de plancton seleccionado vivo o congelado junto, con preparaciones de tejido de peces, moluscos o crustáceos frescos y/o congelados.
-
El uso de plancton seleccionado vivo y/o congelado en unión con materiales alimenticios secos o dietas completas formuladas en forma artificial.
-
El uso exclusivo de dietas artificiales completas microencapsuladas, microparticuladas o en forma de hojuelas.
A la fecha, la mayor parte de las operaciones de los criaderos comerciales de peces y camarones marinos, se atienen al uso exclusivo de una sucesión de organismos vivos o zooplancton, y en particular el rotífero Brachionus plicatilis (rango de tamaño: 100–400 μ, peso húmedo 0.003 mg) y la Artemia salina (rango de tamaño de nauplios recién eclosionados: 420–520μ, peso húmedo de 0.01–0.03μg, peso seco de 1.6–3.3μg; quistes hidratados descapsulados con un rango de tamaño 200–270μm), para el ciclo de cultivo larvario. La producción masiva y los valores nutritivos del alimento vivo no serán discutidos aquí, ya que este aspecto será cubierto en un manual separado (“La producción de alimento vivo y su importancia en acuicultura”, Torrentera Blanco y Tacon; en preparación). En la Tabla 7 se resumen los regímenes alimenticios con organismos vivos, corrientemente empleados para la propagación masiva de la mayor parte de peces y camarones cultivados. A pesar de la eficiencia económica de un sistema de producción de crías de peces y camarones marinos usando alimento vivo, existe un gran número de desventajas asociadas con una estrategia de alimentación intensiva en un sistema de éste tipo (Tacon, 1986), incluyendo:
-
Altos costos de inversión inicial - construcción de instalaciones caras y sofisticadas para la producción de alimento vivo, lo que incluye un laboratorio con requerimientos elevados de energía y servicios.
-
Requerimientos de espacio/terreno - espacios de gran valor en el criadero, que en lugar de utilizarse en la producción de larvas se usan para producción de alimento vivo. Por ejemplo, se recomienda destinar para la producción de algas, por lo menos el 20 % de la capacidad total de los tanques de cría de larvas en criaderos de camarón (sistema “Satul”) (Kungvankij, 1982).
-
Requerimientos de cultivo y mantenimiento de cepas - los regímenes de alimentación involucran el uso de especies puras de algas/diatomeas y de líneas específicas de rotíferos, los cuales requieren del mantenimiento constante de cepas de cultivo a través del año; usualmente requieren la construcción de laboratorios con aire acondicionado para este propósito.
-
Requerimientos de mano de obra - el mantenimiento y la producción de organismos como alimento vivo requieren de mucha mano de obra, así como un alto grado de destreza y capacitación del personal técnico encargado de este trabajo (i.e. para producción de algas/diatomeas y rotíferos).
-
Desarrollo de criaderos a pequeña escala o “de patio” - los altos costos de inversión y los requerimientos de trabajadores con alto nivel de entrenamiento para la producción convencional de alimento vivo, no favorece el desarrollo de criaderos a pequeña escala por los granjeros tradicionales, que poseen recursos económicos limitados y bajo nivel técnico.
-
Efectos climáticos - la producción de organismos para alimento vivo en tanques al aire libre son afectados por las condiciones climáticas, resultando en una supervivencia larval variable (a través de mortalidades en el cultivo o bien de explosiones de población), dependiendo de la estación.
-
Calidad variable y valor nutritivo - la calidad y el valor nutritivo de los organismos como alimento vivo es muy variable y dependen principalmente de la línea genética, del origen y del método de cultivo usado. Para evitar esta variabilidad, se debe utilizar una gran variedad de dietas enriquecidas artificiales para la producción de alimento vivo (i.e. Nauplios de Artemia, rotíferos; para una revisión ver Watanabe, Kitajima y Fujita, 1983; Leger et al., 1987; Leger, Sorgeloos y Chamorro, 1987).
-
Disponibilidad y Costos - En base a las técnicas de cultivo usadas en el Centro Oceanológico de Bretaña (Francia), los costos en peso seco de Brachionus y nauplios de Artemia han sido estimados sobre USC $ 2,000/kg y $ 220/kg, respectivamente (Girin, 1977). En adición, en muchos países en desarrollo la importación de quistes de artemia requieren permisos de importación, impuestos y la disponibilidad de moneda extranjera.
-
Riesgos de Infección Larvaria - existe el peligro de que los organismos del alimento vivo puedan hospedar patógenos (por ingestión o contaminación; incluyendo bacterias, virus y hongos) los cuales posteriormente pueden transferirlos a las larvas en desarrollo.
Tabla 7. Regímenes de alimentación con alimento vivo para larvas de peces y camarones marinos.
Especies: CORVINA (Sciaenops ocellatus)
Diámetro de huevo 0.9–1.0 mm
Longitud estándar a la eclosión 1.7–1.8 mm
Metamorfosis completa 28–42 días de la eclosión a 25°C
Fuente del ejemplo de alimentación citado: Holt, Arnold y Riley 1987). Temperatura: 25–30°C, salinidad: 25–30 partes/mil (ppm). Densidad larvaria: 10– 20/1 para los primeros 10 días, 1–2/1 próximos 14 días, 0.5/1 próximos 14 días. Sobrevivencia: 5–10 % después de los 30 días. Longitud de los peces en el momento de la metamorfosis es de 25 mm aproximadamente.

Lecturas recomendadas: Roberts, Morey, Henderson y Halscott (1978), Anon (1986), Chamberlain, Miget y Haby (1987), Henderson-Arzapalo (1987) y Holt (1987).
Especie: CORVINA EUROPEA (Dicentrarchus labrax)
Diámetro de los huevos 1.1–1.3 mm
Longitud estándar a la eclosión 3.5–4.0 mm
Peso húmedo a la eclosión 0.25–0.45 mg
Metamorfosis completa a los 50–60 días desde la eclosión a 20°C.
Fuente del ejemplo de alimentación citado: Freddi (1985) Temperatura: 20°C Salinidad: 35 ppm densidad larvaria: incubación de los huevos 50–70/1 (eclosión 90 %, viabilidad 95 %). Supervivencia: 15–20 % al final de la metamorfosis (c. día 60) desde la incubación de los huevos. El peso de los peces en la metamorfosis es cerca de 50 mg.

Lecturas recomendadas: Lumare (1978), Girin (1979), Kentouri (1980), Gatesoupe y Luquet (1981), Gatesoupe y Robin (1982), Johnson y Katavic (1984), Ravagnan (1984), Barnabe (1986), Hadj Kacem, Aldrin y Romestand (1986) Johnson y Katavic (1986), Katavic (1986).
Especie: BREMA DORADA (Sparus aurata)
Diámetro de los huevos 0.9–1.0 mm
Longitud estándar a la eclosión 2.0–2.5 mm
Peso húmedo a la eclosión 0.2–0.3 mg
Metamorfosis completa 50–60 días de la eclosión a 23°C
Ejemplo citado de alimentación: Freddi (1985)
Temperatura: 23°C, salinidad: 35 ppm, incubación/día 10–60, 25 ppm de la eclosión hasta el día 10. Densidad larvaria: Incubación de huevo 50–70/l (eclosión 90 %, viabilidad 80 %). Supervivencia: 10–15 % hasta el final de la metamorfosis desde la incubación de los huevos.

Lectura recomendada: Lumare (1978), Person-Le Ruyet y Verillaud (1980), Freddi, Berg y Bilio (1981), Kentouri, Divanach y Paris (1981), Tandler y Helps (1985), Barnabe (1986).
Especie: LENGUADO O PEZ PLANO INGLES (Scophthalmus maximus)
Diámetro de los huevos 0.9–1.2 mm
Longitud estándar a la eclosión 2.1–2.8 mm
Peso húmedo en la eclosión 0.1–0.3 mg
Metamorfosis completa 30–40 días de la eclosión a 15–18°C
Ejemplo de alimentación citado: Person-Le Ruyet (1986) Temperatura: 18–20°C. Salinidad: 20–34 ppm. Densidad larvaria: 20–40/1 a los días 20–25, después 5/1. Supervivencia 0–40 % al final de la metamorfosis. Peso de los peces después de un mes más o menos 50–70 mg.

Lectura recomendada: Kuhlman, Quantz y Witt (1981), Getesoupe (1982), Bromley y Howell (1983), Person-Le Ruyet et. al., (1983). Para la composición de las dietas de destete vea Lumare (1978), Getesoupe (1982) y Person-Le Ruyet et al., (1983).
Especie: PLATIJA (Solea solea/S. vulgaris)
Diámetro de los huevos 1–1.6 mm
Longitud estándar a la eclosión 2.5–3.8 mm
Peso húmedo a la eclosión 0.4–0.6 mg
Metamorfosis completa 15 días de la eclosión (17–19°C)
Ejemplo de alimentación citado: Person-Le Ruyet (1986)
Temperatura 18–20°C. Salinidad 20–34 ppm. Densidad Larvaria 50–80/1, después de la metamorfosis 2–10,000/m². Supervivencia 60–80 % a un mes. Peso después de 1 mes es cerca de 50–75 mg. Período normal de separación 25–30 días después de la eclosión; el período puede ser reducido a 10–15 días por el uso de dietas granuladas semihúmedas (Gatesoupe, 1983)*

Lecturas recomendadas: Girin y Person-Le Ruyet (1977), Lumare (1978), Metailler, Menu y Moriniere (1981), Cadena Roa et al., (1982); Fuchs (1982), Gatesoupe (1983), Metailler et al., (1983), Dendrinos et al., (1984).
* Densidades larvarias usadas de 15–28/1. Tamaño del alimento 315 mm desde el día 10, 650 mm hasta el día 17, alimentación continua durante el día.
Especie: LISA GRIS (Mugil cephalus)
Diámetro de huevos 0.8–1.0 mm
Longitud estándar a la eclosión 2.2–3.5 mm
Peso húmedo a la eclosión 0.2–0.3 mg
Metamorfosis completa 40–50 días de la eclosión a 20–22°C.
Fuente del ejemplo de alimentación: Nash y Konongsberger (1981)
Temperatura 20–22°C. Salinidad 32–35 ppm, reduciéndose a 30 ppm por el día 7 y 20 ppm en el día 30. Densidad larvaria no más de 6/1 al inicio, con densidad anticipada al día 21 de 0.33/1. Supervivencia 5 % del número original de huevos después del 50-días del ciclo de cultivo.

Lectura recomendada: Nash, Kuo y McConnell (1974), Kuo y Nash (1975), Liao (1975), Lumare (1978), Nash y Shehadeh (1980), Cataudella et al., (1988).
Especie: PEZ CONEJO (Siganus guttatus)
Diámetro promedio del huevo 0.45–0.6 mm
Longitud estándar a la eclosión 2 mm
Metamorfosis completa 24–35 días de la eclosión a 26–32°
Fuente del ejemplo de alimentación: Juario et al., (1985) Temperatura 26–30°C. Salinidad 34 ppm. Densidad larvaria 5–125/1. Supervivencia larvaria 0.7–24.7% (al día 35).

Lectura recomendada: * Dieta artificial - Pascual (1979), Akatsu, El-Zahr y Al-Aradi (1983)
Especie: MERO CAFE MOTEADO (Epinephellus tauvina)
Diámetro promedio de los huevos 0.75 mm
Longitud estándar a la eclosión 2.25 mm
Metamorfosis completa 30–40 días de la eclosión a 27–31°C
Fuente del ejemplo de alimentación citado: Akatsu, Al-Abdul-Elah y Teng (1983) Temperatura 27–31°C. Salinidad 25 ppm. Densidad larvaria 52/1 por días 1–20, reduciendo a 1/1 del día 21–40. Supervivencia 31–55% a 27–29°C día 1–12; 85–91% supervivencia a 31°C del día 19–33.

Lectura recomendada: Chen et al., (1977), Hussain y Higuchi (1980).
Especie: PERCA MARINA GIGANTE/LOBINA MARINA (Lates calcarifer)
Diámetro promedio de los huevos 0.8 mm
Longitud estándar a la eclosión 1.5 mm
Metamorfosis completa 18–20 días de la eclosión a 27°C
Fuente del ejemplo de alimentación: Tattanon y Maneewongsa (1982)
Temperatura 27°C. Salinidad 20 ppm. Supervivencia 85% de la tasa de eclosión de los huevos, 37% al día 1–7, 81% al día 8–15, 70% al día 16–23, 85% al día 24–30. Densidad larvaria 30–40/l al día 1–7, 15–20/1 al día 8–15, 5–10/l al día 16–23, 2–5/l al día 24–30.

Lectura recomendada: FAO/SCS (1982), Moore (1982), Bagarinao y Kungvankij (1986)
Especie: SABALOTE (Chanos chanos)
Diámetro de los huevos 0.8–1.2 mm
Longitud estándar a la eclosión 3.5–4.3 mm
Metamorfosis completa 18–21 días de la eclosión a 26–29°C
Fuente del ejemplo de alimentación: Juario et al., (1984) Temperatura 26–29°C. Salinidad 34 ppm. Densidad larvaria 8–17/1 (incubación de huevos fertilizados). Supervivencia larvaria 19–56% (sobre los 21 días)

Lectura recomendada: Vanstone et al., (1977), Chaudhuri et al., (1978), Liao et al., (1979), Santiago, Banes-Aldaba y Songalia (1983), Durary y Bagarinao (1984), Juario y Storch (1984), Panteístico, Baldia y Reyes (1986).
Especie: CAMARON DE AGUA DULCE (Macrobrachium rosenbergii)
Diámetro promedio de los huevos 0.6–0.7 mm
Longitud estándar a la eclosión 1.9–2.0 mm
Metamorfosis completa 25–45 días de la eclosión a 25–30°C.
Fuente del ejemplo de alimentación citado: AQUACOP (1984)
Temperatura 29–31°C. Salinidad 10–12 ppm. Densidad larvaria 100/1 (inicial) Supervivencia 5–74% después de 37–40 días. Tamaño a P1 7–8 mm de longitud standard

* Alimento dado a las 08:00 hrs. y 10:00 hrs. Dieta típica: 20% de carne de calamar, 20% de carne de camarón, 20% de huevo de gallina, 20% de hueva de arenque, 2% de vitaminas, 1% de minerales 15% de aceite de bacalao, alginato 2% (todo en base seca).
Lectura recomendada: Uno y Kwon Chin Soo (1969), Fujimura y Okamoto (1970), Dungan, Hagwood y Frakes (1975), Cohen, Finkel y Sussman (1976), Hagwood y Willis (1976), Nai-Hsien Chao y Liao (1977), Menasveta y Piyatiraatitivokul (1980), Adisukresno, Escritor y Mintardjo (1982), New (1982), New y Singholka (1982),
Tansakul (1983), Kwong (1984), Meyers y Hagwood (1984).
Especie: CAMARONES MARINOS PENEIDOS - DATOS GENERALES
Diámetro promedio de los huevos 0.25–0.29 mm
Longitud estándar a la eclosión 0.3–0.4 mm
Metamorfosis completa 10–15 días de la eclosión a 25–30°C
Tamaño a Pl 4–5 mm de longitud total
Fuente del ejemplo de alimentación: Vielka Morales de Ruiz - Comunicación Personal, Panamá, Marzo (1988). Especies de Camarón: P. vannamei. Temperatura 27–29°C. Salinidad 30–35 ppm. Densidad larvaria 60/1 (nauplios). Supervivencia 50% de nauplios a la Pl.

Lectura recomendada: Liao y Hung (1973), Heinen (1976), Kafuku y Ikenoue (1983), AQUACOP (1984), Treece (1985), Kitani (1986, 1986a), Leger, Sorgeloos y Chamoro (1987).
Programa general de alimentación
LARVAS DE PECES MARINOS - JAPON (Watanabe, Kitajima y Fujita (1983)

Lectura recomendada: Fujita (1979), Kuronuma y Fukusho (1984).
Programa general de alimentación
LARVAS DE CAMARONES MARINOS - TAHITI (AQUACOP, 1983a) Densidad larvaria inicial 100–120/l. Temperatura 25–29°C. Salinidad 35 ppm. pH 8.2.

Tasa de supervivencia: 65–80% de nauplio al estado P4 para P. merguiensis, P. indicus, P. vannamei y P. stylirostris; 45% de nauplios a estado P4 para P. monodon
Programa general de alimentación
LARVAS DE CAMARONES MARINOS - USA (Treece, 1985)
Densidad larvaria inicial 100–120/l. Temperatura 27–29°C. Salinidad 25–35 ppm pH 7.8 – 8.2. No se da ningún dato de supervivencia.

Lectura recomendada: Yang (1975), Mock, Revera y Fontaine (1980), Simon (1981), Wilkenfeld, Lawrence y Kuban (1984), Chamberlain, Haby y Miget (1985), Kuban, Lawrence y Wilkenfeld (1985), Sanchez (1986).
Programa general de alimentación
LARVAS DE CAMARONES MARINOS - FILIPINAS (Kungvankij et al., 1986). Densidad larvaria inicial 100–150/l. Temperatura 26–31°C. Salinidad 30–32 ppm. pH 7.5– 8.5; Supervivencia 30–40% a P1 para P. monodon.

Lectura recomendada: Mochizuki (1978), Yap (1979), FAO/SCP (1982a), Tobias-Quinitio y Villegas (1982), Liao (1984), SEAFDEC (1984).
En el pasado, se han hecho intentos para reemplazar el alimento vivo por alimento inerte o por dietas artificiales completas, resultando en reducción de la supervivencia larval, retardo del desarrollo larval y a menudo mortalidad total de las larvas (New, 1976, Seidel et al., 1980). En mayor grado, esto se ha debido al uso inadecuado de las técnicas de manejo del alimento (i.e. presentación del alimento e infrecuente intercambio del agua, pobre entendimiento del comportamiento alimenticio larval y de
los requerimientos alimenticios físicos), pobre estabilidad del alimento en el agua y una consecuente pérdida de nutrientes solubles e incremento en la contaminación de esta.
Por otro lado, recientes desarrollos en el entendimiento de la nutrición larval (i.e. altos requerimientos dietéticos de ácidos grasos altamente insaturados - Leger, Sorgeloos y Chamorro, 1987; Cho, Cowey y Watanabe, 1985), la fisiología de la digestión de las larvas (i.e. posibles requerimientos dietéticos para la preparación de enzimas purificadas/enzimas “disparadoras” y por ingredientes alimenticios altamente digeribles o solubles - Cruz-Ricque y AQUACOP, 1987, Maugle et al., 1982, 1983, 1983a, Kanazawa et al., 1982, Jones, Kurmaly y Arshard, 1987, Dabrowski, 1984), el alimento larval (i.e. la importancia de la frecuente alimentación y el diseño del tanque - Charlon y Bergot, 1984, Teshima y Kanazawa, 1983, Dabrowski y Kaushik, 1985), y las técnicas de manufactura del alimento larval (Meyers, 1979; Cho, Cowey y Watanabe, 1985; Mylvaganam, 1988), han estimulado un renaciente interés en el desarrollo artificial de dietas para larvas con el fin de reemplazar el alimento vivo durante el ciclo de crianza.
Recientemente se han introducido dos nuevos sistemas de dietas artificiales como alternativas “viables” para los sistemas de producción de alimento vivo: 1) el uso exclusivo de microencapsulados rehidratables o micropartículas para la dieta larval (Cho, Cowey y Watanabe, 1985; Mylvaganam, 1988; Meyers, 1979) y 2) el uso exclusivo de una suspensión de tejido de crustáceos (Hameed Ali, Dwivedi y Alikunhi, 1982; Tacon, 1986a; Kungvankij et al., 1987). Aunque ambos métodos descansan en un solo tipo de alimentación, el alimento no vivo para la fase larval de cultivo completo, difiere en los recursos de alimentación usados y en el grado de sofisticación de la preparación de los alimentos. Para una revisión de las técnicas de preparación de dietas larvales a través de microencapsulados y micropartículas ver a Gatesoupe y Luquet (1977); Jones, Kanazawa y Rahman (1979); Chow (1980); Kanazawa et al., (1982, 1982a); Teshima y Kanazawa (1983); Scura, Fischer y Yunker (1984); Jones et al., (1984); Le Moullac et al., (1987); y Galgani y AQUACOP (1988). Por ejemplo, la Tabla 8 resume los resultados de Kanazawa et al., (1982) con larvas de Penaeus japonicus usando una variedad de microencapsulados y dietas artificiales microprotegidas.
Tabla 8. Efectos de diferentes regímenes de alimentación con diferentes dietas artificiales sobre el crecimiento y supervivencia de larvas de Penaeus japonicus (densidad larval inicial 100 Z1/800 ml, salinidad 34–35 ppm, Temperatura 27–29° C; Fuente: Kanazawa, et al., 1982a).

¹ Las dietas encapsuladas nylon-proteína fueron preparadas por el procedimiento de polimerización interfacial de Chang, Macintosh y Mason (1966) modificado por Jones, et al., (1976) usando 1,6-diaminohexano, cloruro de sebacoyl y una suspensión de dieta finamente molida (menor de < 10–20 µm) para ser encapsulada.
² A 2 g de extracto de misidáceos o dieta A, se añadió huevo de gallina (1.34 g en peso seco) entero y se preparó el homogeneizado (20 ml) con agua destilada (1:1, v/v) y se encapsuló.
³ Para proporcionar una concentración de 500–700 capsulas/ml de agua.
⁴ Para la composición de la dieta A ver la Tabla 5 (Formulación 19: Kanazawa, Teshima y Tokiiwa., 1979).
⁵ Dieta microencapsulada Zein (método etanol); la dieta en polvo (6 g) se mezcló con Zein (1.2 g) disuelta en 76% etanol (74 ml) con agitación continua, y el agua destilada (150 ml) se añadió gota a gota a esta suspensión para formar la dieta zein microencapsulada.
⁶ Dieta Zein microencapsulada (método de hidróxido de sodio); la dieta en polvo (7 g) se suspendió con agitación continua mediante un agitador magnético, en una solución de hidróxido de sodio (pH 12, 70 ml) conteniendo Zein (1.4 g). La suspensión se diluyó con agua destilada (120 ml) y con ácido acético acidificado a un pH de 4.5 para formar la dieta microencapsulada de Zein.
⁷ Dieta comercial para P. japonicus (Evian, Kyowa-Hakko Kogyo Co. Ltd).
⁸ La dieta microprotegida Zein se preparó primero secando, quebrando y tamizando la mezcla de los ingredientes de la dieta. A las dietas ya en polvo (menos de 10–20; 8 g), se añadió Zein (5 g) disuelto en 60% etanol (25 ml), se mezcló vigorosamente, y se calentó en un horno a 40°C de 24 a 48 h. La dieta seca se molió a partículas de 10–50 µm.
⁹ El grupo control fue alimentado con Chaetoceros gracilis (50–70,000 células/ml) hasta el estado mysis y entonces se alimentaron con Nauplios de Artemia recientemente eclosionados (15 nauplios/ml).